Железа карбонилы
ЖЕЛЕЗА КАРБОНИЛЫ. Пентакарбонилжелезо Fe(CO)5 - желтая летучая жидкость. Молекула имеет конфигурацию тригональной бипирамиды. Т. пл. — 20 °С, т. кип. 102,5°С (с разл.); d420 1,46; давление пара 27,93 гПа (20 °С); начинает разлагаться при 60 °С. Раств. в орг. р-рителях. Окисляется О2 воздуха, к-тами, галогенами, напр.:Fe(CO)5 + Вг2 : [цис-Fе(СО)4Вr2] + CO
Реагирует с анионом ОН-:
Fe(CO)5 + 2ОН- : [FeH(CO)4]- + HCO3-
Восстанавливается щелочными металлами до карбонилферратов:
Fe(CO)5 + 2Na : Na2[Fe(CO)4] + СО
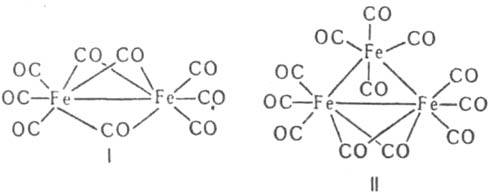
О хим. св-вах см. также Карбонилы металлов. Получают Fe(CO)5 р-цией СО с Fe при 180-200 °С и давлении 16-20 МПа; чаще всего используют губчатое железо или сплав Fe с серой (5-7%). Fe(CO)5 огнеопасен; токсичен, ПДК 0,8 мг/м3. Нонакарбонилдижелезо Fe2(CO)9 (ф-ла I) - золотисто-желтые кристаллы; т. разл. 100°С. Плохо раств. в орг. р-рителях. Медленно окисляется на воздухе. Легко диссоциирует: Fe2(CO)9 : Fe(CO)5 + Fe(CO)4; образующийся Fe(CO)4 быстро присоединяет разл. лиганды, давая комплексы [Fe(CO)4L], где L - фосфины, ненасыщенные орг. соед. и др. Благодаря легкости образования Fe(CO)4 реакц. способность Fe2(CO)9 выше, чем у Fe(CO)5, и во мн. случаях чем у Fe3(CO)12. Реагирует с анионом ОН-, давая [Fe2(CO)8]2- . Получают его фотолизом Fe(CO)5. Додекакарбонилтрижелезо Fe3(CO)12 (ф-ла II) - черно-зеленые кристаллы; т. разл. 140-150°С, т. возг. 70°С/0,1 мм рт. ст. (с разл.). Незначительно раств. в орг. р-рителях. Медленно разлагается при комнатной т-ре с образованием иногда пирофорного Fe. Получают его действием МnО2 на [FeH(CO)4]-, соляной или муравьиной к-ты на [Fe3H(CO)11] , Н2О2 или КМnО4 на [Fe(CO)4]2-, а также при нагр. Fe2(CO)9.
Железа карбонилы применяют в произ-ве порошка карбонильного железа, предназначенного для изготовления магнитов, слоев на магнитофонных лентах, фасонных деталей, для синтеза железооксидных пигментов, Fe2O3 для ферритов, как катализаторы в орг. синтезе (напр., изомеризации и теломеризации олефинов). Железа карбонилы - осн. исходные соед. в синтезе железоорг. соединений. Лит. см. при ст. Карбопилы металлов. Л. В. Рыбин.
