Олова оксиды
ОЛОВА ОКСИДЫ. Монооксид SnO-черные кристаллы, кристаллич. решетка тетрагональная типа РbО (а = 0,3802 нм, с = 0,4838 нм, z = 2, пространств, группа P42/nmm); плотн. 6,446 г/см3; 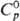 47,8 Дж/(моль • К);
47,8 Дж/(моль • К); 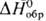 — 280,7 кДж/моль;
— 280,7 кДж/моль; 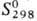 57,2 Дж/(моль·К); при давлении выше 90 ГПа переходит в ромбич. модификацию (а = 0,382 нм, b = 0,361 нм, с — 0,430 нм, z = 2, пространств. группа Рт2п); не раств. в воде. Амфотерен, преобладают основные св-ва; раств. в к-тах с образованием солей Sn2+; в кислых р-рах - восстановитель, окисляется до Sn4+; на воздухе выше 400 °С окисляется до SnO2; без доступа О2 выше 180°С диспропорционирует на SnO2 и Sn. Полупроводник р- или n-типа в зависимости от условий получения: дырочную проводимость [r (0,33-1)·104 Ом·см] имеют кристаллы, полученные осаждением из р-ров SnCl2 содой или NH3 и высушенные при т-рах до 100 °С; SnO, полученный любым способом при т-рах выше 180°С, имеет электронную проводимость.
57,2 Дж/(моль·К); при давлении выше 90 ГПа переходит в ромбич. модификацию (а = 0,382 нм, b = 0,361 нм, с — 0,430 нм, z = 2, пространств. группа Рт2п); не раств. в воде. Амфотерен, преобладают основные св-ва; раств. в к-тах с образованием солей Sn2+; в кислых р-рах - восстановитель, окисляется до Sn4+; на воздухе выше 400 °С окисляется до SnO2; без доступа О2 выше 180°С диспропорционирует на SnO2 и Sn. Полупроводник р- или n-типа в зависимости от условий получения: дырочную проводимость [r (0,33-1)·104 Ом·см] имеют кристаллы, полученные осаждением из р-ров SnCl2 содой или NH3 и высушенные при т-рах до 100 °С; SnO, полученный любым способом при т-рах выше 180°С, имеет электронную проводимость.
Получают SnO разложением SnO2, гидроксида, оксалата или нек-рых др. солей Sn2 + в вакууме, атмосфере N2 или др. инертного газа, а также окислением Sn. Используют SnO для получения солей Sn2 +, как катализатор р-ций замещения и гидролиза, черный пигмент в произ-ве стекла, восстановитель в металлургии.
Диоксид SnО2-бесцв. кристаллы, кристаллич. решетка тетрагональная типа рутила (а = 0,4738 нм, с — 0,3188 нм, z = 4, пространств, группа P42/nmm); т. пл. 1630 °С; плотн. 7,0096 г/см3; 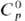 53,2 Дж/ (моль • К);
53,2 Дж/ (моль • К);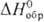 -577,63 кДж/моль;
-577,63 кДж/моль; 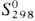 49,01 Дж/(моль·К). Испаряется преим. в виде SnO, в парах присутствуют также О2 и оксиды SnnОn, где п = 2, 3 или 4; ур-ния температурной зависимости давления пара: lg p(SnO,Пa) = 14,55-20450/Т, lg р(О2, Па) = 13,22-20000/Т. Не раств. в воде; устойчив в водных р-рах к-т, солей, щелочей, разл. восстановителей. При сплавлении со щелочами и карбонатами образует станнаты М2 [Sn(OH)6]; при нагр. в присут. восстановителей превращ. в металл. SnO2-полупроводник n-типа; ширина запрещенной зоны 3,54 эВ (300 К); подвижность электронов 7см2/(В·с); концентрация носителей заряда 3,5·1014 см-3;
49,01 Дж/(моль·К). Испаряется преим. в виде SnO, в парах присутствуют также О2 и оксиды SnnОn, где п = 2, 3 или 4; ур-ния температурной зависимости давления пара: lg p(SnO,Пa) = 14,55-20450/Т, lg р(О2, Па) = 13,22-20000/Т. Не раств. в воде; устойчив в водных р-рах к-т, солей, щелочей, разл. восстановителей. При сплавлении со щелочами и карбонатами образует станнаты М2 [Sn(OH)6]; при нагр. в присут. восстановителей превращ. в металл. SnO2-полупроводник n-типа; ширина запрещенной зоны 3,54 эВ (300 К); подвижность электронов 7см2/(В·с); концентрация носителей заряда 3,5·1014 см-3; 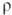 3,4·103 Ом·см. При легировании элементами V гр. (напр., Sb) электрич. проводимость SnO2 увеличивается в 103-105 раз. SnO2 прозрачен для видимого света и отражает ИК излучение с длиной волны выше 2 мкм.
3,4·103 Ом·см. При легировании элементами V гр. (напр., Sb) электрич. проводимость SnO2 увеличивается в 103-105 раз. SnO2 прозрачен для видимого света и отражает ИК излучение с длиной волны выше 2 мкм.
В природе SnO2-минерал касситерит (оловянный камень).
Поликристаллич. SnO2 получают прокаливанием солей Sn (IV) на воздухе, осаждением оловянных к-т из р-ров солей Sn и их послед. прокаливанием на воздухе при т-рах до 1230°С. Монокристаллы SnO2 выращивают из паровой фазы с использованием процессов окисления, пиролиза или гидролиза соед. Sn, из р-ров гидротермальным синтезом. Пленки SnO2 получают окислением пленок Sn, методом хим. транспортных р-ций из хлоридов Sn или оловоорг. соед. с их послед. пиролизом или гидролизом на подложках, конденсацией SnO2 в вакууме из паровой фазы, содержащей Sn, O2 и SnO.
Используют SnO2 в виде порошков и керамики в произ-ве прозрачных, электропроводящих и теплоотражающих материалов, как белый пигмент в произ-ве стекла и жаропрочных эмалей и глазурей, катализатор р-ций замещения и гидролиза. Тонкие пленки SnO2, нанесенные на стеклянные или полиэтиленовые подложки, используют в качестве антиобледенителей в самолетах, автомобилях и др. транспортных ср-вах, теплоизолирующих окон в помещениях, обогреваемых солнечным светом, прозрачных проводящих покрытий в электронных приборах. Касситерит - сырье в произ-ве Sn.
Гидраты олова оксидов -SnO·H2O, или гидроксид Sn(OH)2, SnO2·xH2O, или оловянные к-ты (см. Олово), образуются при щелочном гидролизе соотв. SnCl2 и SnCl4. SnO·H2O-бесцв. аморфное в-во, с р-рами щелочей образует станнаты (II) M[Sn(OH)3], быстро разлагающиеся на станнаты (IV) M2[Sn(OH)6] и Sn, что используется при нанесении покрытий из олова.
Лит.: Вайнштейн В. М., Фистуль В. И., в кн.: Итоги науки и техники. Сер. Электроника и ее применение, т. 4, М., 1973, с. 108-52; Jarzebski Z. М., М art on J. P., "J. Electrochem. Soc.", 1976, v. 123, №7, p. 199C-205C; № 9, p. 299C-310C; № 10, p. 333C-346C; Chopra K. L., Major S., Panel у a D. K., "Thin Solid Films", 1983, v. 102, № 1, p. 1-46.
П. В. Ковтуненко, И. Л. Нестерова.
