Тербий
ТЕРБИЙ (от назв. селения Иттербю, Ytterby, в Швеции; лат. Terbium) Tb, хим. элемент III гр. периодич. системы, ат. н. 65, ат. м. 158,9254; относится к редкоземельным элементам (иттриевая подгруппа лантаноидов). В природе один стабильный изотоп 159Тb. Конфигурация внеш. электронных оболочек 4f9 5s2 5p6 6s2; степени окисления +3, + 4, + 1; энергии ионизации при последоват. переходе от Тb0 к Тb5+ соотв. 5,85, 11,52, 21,91, 39,79, 66,5 эВ. Электроотрицательность 1,0-1,2; атомный радиус 0,177 нм, ионные радиусы, нм (в скобках даны координац. числа): ТЪ3+ 0,106(6), 0,112(7), 0,118(8), 0,124(9), Тb4+ 0,090(6), 0,102(8).
Содержание в земной коре 4,3·10-4% по массе, в морской воде ~ 10-7 мг/л. Вместе с др. РЗЭ содержится в минералах ксенотиме, эвксените, монаците, бастнезите, лопарите, гадо-лините и др.
Свойства. Тербий -серебристо-белый металл. Известны три модификации: a-Tb с гексагон. кристаллич. решеткой типа Mg, а = 0,36010 нм, с = 0,56936 нм, z = 2, пространств. группа P63/mmc, плотн. 8,272 г/см3; b-Tb с кубич. решеткой типа a-Fe, а — 0,402 нм, z = 2, пространств. группа Im3m, плотн. 8,12 г/см3; при давлении 1ГПа образуется тригон. модификация типа Sm. а = 0,883 нм, a = 23,42°, z = 3, пространств. группа 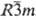 ; т-ра полиморфного перехода a
; т-ра полиморфного перехода a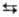 b 1287°С, DH перехода 5 кДж/моль; т. пл. 1357°С, т. кип. 3227 °С; 29Дж/(моль·К);,
b 1287°С, DH перехода 5 кДж/моль; т. пл. 1357°С, т. кип. 3227 °С; 29Дж/(моль·К);,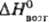 388 кДж/моль,
388 кДж/моль,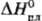 10,8 кДж/моль;
10,8 кДж/моль;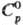
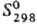 73,5 Дж/(моль·К); давление пара 10 кПа (1357°С); температурный коэф. линейного расширения 1,18·10-5 К-1; r 1,16·10-6 Ом·м; для a-Tb точка Кюри 219,6 К, точка Нееля 230,2 К; твердость по Бринеллю литого образца 677 МПа (20 °С). Легко поддается механической обработке.
73,5 Дж/(моль·К); давление пара 10 кПа (1357°С); температурный коэф. линейного расширения 1,18·10-5 К-1; r 1,16·10-6 Ом·м; для a-Tb точка Кюри 219,6 К, точка Нееля 230,2 К; твердость по Бринеллю литого образца 677 МПа (20 °С). Легко поддается механической обработке.
На воздухе компактный тербий окисляется медленно, при нагр. во влажном воздухе-неск. быстрее. Реагирует с минер. к-тами, медленно окисляется кипящей водой, взаимод. с галогенами, халькогенами, N2, H2 при нагр., давая произвол" ные Тb(III). Ион Тb3+ в водных средах весьма устойчив, имеет розовую окраску, трудно окисляется и не восстанавливается. Тb+ известен только в виде монохлорида TbCl (черные кристаллы тригональной сингонии, пространств, группа 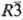 ), гидролизуется водой. В водных р-рах Тb4+ существует лишь в виде малостабильных гетерополиани-онов. В твердых фторидах и оксидах Tb(IV) существенно стабильнее.
), гидролизуется водой. В водных р-рах Тb4+ существует лишь в виде малостабильных гетерополиани-онов. В твердых фторидах и оксидах Tb(IV) существенно стабильнее.
Оксиды тербия - темно-коричневые твердые в-ва. Наиб. устойчив нестехиометрич. оксид состава Тb4О7, к-рый получают прокаливанием соединений тербия на воздухе при 800-1000 °С. Диоксид ТbО2 (.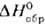 — 970,6 кДж/моль) образуется при давлении О2 выше 15 МПа и т-ре ~ 300 °С, при обработке Тb4 О7 слабым р-ром СН3 СООН либо при кипячении TbF4 в щелочной среде; сесквиоксид Тb2О3 (т. пл. 2390 °С, — 1863,4 кДж/моль)-при разложении гидроксида или др.
— 970,6 кДж/моль) образуется при давлении О2 выше 15 МПа и т-ре ~ 300 °С, при обработке Тb4 О7 слабым р-ром СН3 СООН либо при кипячении TbF4 в щелочной среде; сесквиоксид Тb2О3 (т. пл. 2390 °С, — 1863,4 кДж/моль)-при разложении гидроксида или др.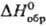 кислородсодержащих соед. Тb(III).
кислородсодержащих соед. Тb(III).
Тетрафторид TbF4-бесцв. кристаллы моноклинной сингонии типа UF4; 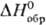 -1776 кДж/моль; ок. 550 °С разлагается до TbIII(TbIVF5)3, выше 600°С-до TbF3; получают взаимод. F2 или др. сильных фторирующих агентов с TbF3 или Тb4О7 при 350-500°С. Трифторид TbF3-бесцв. кристаллы ромбич. сингонии; плотн. 7,23 г/см3; выше 950 °С существует гексагон. модификация; плотн. 7,50 г/см3; т. пл. 1177°С;
-1776 кДж/моль; ок. 550 °С разлагается до TbIII(TbIVF5)3, выше 600°С-до TbF3; получают взаимод. F2 или др. сильных фторирующих агентов с TbF3 или Тb4О7 при 350-500°С. Трифторид TbF3-бесцв. кристаллы ромбич. сингонии; плотн. 7,23 г/см3; выше 950 °С существует гексагон. модификация; плотн. 7,50 г/см3; т. пл. 1177°С; 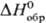 — 1700,8 кДж/моль; получают осаждением из водных р-ров солей Tb(III) фтористоводородной к-той, р-цией Тb4О7 с HF, F2 при 400-500 °С и др. способами; применяют для металлотермич. получения тербия.
— 1700,8 кДж/моль; получают осаждением из водных р-ров солей Tb(III) фтористоводородной к-той, р-цией Тb4О7 с HF, F2 при 400-500 °С и др. способами; применяют для металлотермич. получения тербия.
Трихлорид ТbСl3-бесцв. кристаллы с ромбич. решеткой; выше 510°С существует моноклинная модификация; т. пл. 582 °С, т. кип. 1552 °С; 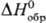 -998,7 кДж/моль; образует гидраты; получают взаимод. смеси Сl2 и ССl4 с оксидом или оксалатом Tb(III) выше 200 °С, обработкой SOCl2 гидрата ТbСl3 при кипячении с послед. перегонкой; применяют для металлотермического получения тербия, а также его соединений.
-998,7 кДж/моль; образует гидраты; получают взаимод. смеси Сl2 и ССl4 с оксидом или оксалатом Tb(III) выше 200 °С, обработкой SOCl2 гидрата ТbСl3 при кипячении с послед. перегонкой; применяют для металлотермического получения тербия, а также его соединений.
Получение. Выделяют тербий из смеси РЗЭ методами экстракции и хроматографии, очищают, как правило, хроматогра-фически. Металлический тербий получают металлотермич. восстановлением ТbСl3 или TbF3.
Тербий используют в качестве активатора люминофоров (зеленое свечение) для телевизионных экранов, люминесцентных ртутных ламп, рентгеновских аппаратов; перспективен для изготовления магн. материалов. Нестехиометрич. оксиды (Тb4О7)-катализаторы, напр. окисления Н2 и N2O. Известно применение также в магн. сплавах.
Тербий впервые выделен в 1834 К. Мосандером из концентрата Y2O3. Л. И. Мартыненко, С. Д. Моисеев, Ю.М. Киселев.
