Бериллий
Бериллий (лат. Beryllium), Be, химический элемент II группы периодической системы Менделеева, атомный номер 4, атомная масса 9,0122; лёгкий светло-серый металл. Имеет один стабильный изотоп 9Be. Открыт в 1798 в виде окиси BeO, выделенной из минерала берилла Л. Вокленом. Металлический бериллий впервые получили в 1828 Ф. Вёлер и А. Бюсси независимо друг от друга. Т. к. некоторые соли бериллия сладкого вкуса, его вначале называли «глюциний» (от греч. glykys — сладкий) или «глиций». Название Glicinium (знак GI) употребляется (наряду с бериллием) только во Франции. Применение бериллия началось в 40-х гг. 20 в., хотя его ценные свойства как компонента сплавов были обнаружены ещё ранее, а замечательные ядерные — в начале 30-х гг. 20 в.
Бериллий — редкий элемент, среднее содержание его в земной коре 6 10-4% по массе. Бериллий — типичный литофильный элемент, характерный для кислых, субщелочных и щелочных магм. Известно около 40 минералов бериллия. Из них наибольшее практическое значение имеет берилл, перспективны и частично используются фенакит, гельвин, хризоберилл, бертрандит (см. Бериллиевые руды).
Физические и химические свойства. Кристаллическая решётка бериллия гексагональная плотноупакованная с периодами а = 2,855 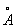 и с= 3,5840
и с= 3,5840 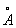 . Бериллий легче алюминия, его плотность 1847,7 кг/м3 (у Al около 2700 кг/м3), tлл 1284°C, tkип 2450°С.
. Бериллий легче алюминия, его плотность 1847,7 кг/м3 (у Al около 2700 кг/м3), tлл 1284°C, tkип 2450°С.
Бериллий обладает наиболее высокой из всех металлов теплоёмкостью, 1,80 кдж/(кг.•К) или 0,43 ккал/ (кг•°С), высокой теплопроводностью, 178 вт/(м•К) или 0,45 кал/см•сек•°С) при 50°С, низким электросопротивлением, 3,6—4,5 мком•см при 20°С; коэффициент линейного расширения 10,3—131 (25—100°С). Эти свойства зависят от качества и структуры металла и заметно меняются с температурой. Модуль продольной упругости (модуль Юнга) 300Гн/м2 (3.104 кгс/мм2). Механические свойства бериллия зависят от чистоты металла, величины зерна и текстуры, определяемой характером обработки. Предел прочности бериллия при растяжении 200—550 Мн/м2 (20—55 кгс/мм2), удлинение 0,2—2%. Обработка давлением приводит к определённой ориентации кристаллов бериллия, возникает анизотропия, становится возможным значительное улучшение свойств. Предел прочности в направлении вытяжки доходит до 400—800Мн/м2(40—80 кгс/мм2), предел текучести 250—600 Мн/м2 (25—60 кгс/мм2), а относительное удлинение до 4—12%. Механические свойства в направлении, перпендикулярном вытяжке, почти не меняются. Бериллий — хрупкий металл; его ударная вязкость 10—50 кдж/м2 (0,1— 0,5 кгс.•м/см2). Температура перехода бериллия из хрупкого состояния в пластическое 200— 400 °С.
В химических соединениях бериллий 2-валентен (конфигурация внешних электронов 2s2). Бериллий обладает высокой химической активностью, но компактный металл устойчив на воздухе благодаря образованию тонкой и прочной плёнки окиси BeO. При нагревании выше 800 °С быстро окисляется. С водой до 100°С бериллий практически не взаимодействует. Легко растворяется в плавиковой, соляной, разбавленной серной кислотах, слабо реагирует с концентрированной серной и разбавленной азотной кислотами и не реагирует с концентрированной азотной. Растворяется в водных растворах щелочей, образуя соли бериллаты, например Na2BeO2. При комнатной температуре реагирует с фтором, а при повышенных — с др. галогенами и сероводородом. Взаимодействует с азотом при температуре выше 650 °С с образованием нитрида Be3N2 и при температуре выше 1200°С с углеродом, образуя карбид Be2C. С водородом практически не реагирует во всём диапазоне температур. Гидрид бериллия получен при разложении бериллийорганических соединений и устойчив до 240°С. При высоких температурах бериллий взаимодействует с большинством металлов, образуя бериллиды; с алюминием и кремнием даёт эвтектические сплавы. Растворимость примесных элементов в бериллии чрезвычайно мала. Мелкодисперсный порошок бериллия сгорает в парах серы, селена, теллура. Расплавленный бериллий взаимодействует с большинством окислов, нитридов, сульфидов и карбидов. Единственно пригодным материалом тиглей для плавки бериллия служит бериллия окись.
Гидроокись Be (OH)2 — слабое основание с амфотерными свойствами. Соли бериллия сильно гигроскопичны и за небольшим исключением (фосфат, карбонат) хорошо растворимы в воде, их водные растворы вследствие гидролиза имеют кислую реакцию. Фторид BeF2 с фторидами щелочных металлов и аммония образует фторбериллаты, например Na2BeF4, имеющие большое промышленное значение. Известен ряд сложных бериллийорганических соединений, гидролиз и окисление некоторых из них протекают со взрывом.
Получение и применение. В промышленности металлический бериллий и его соединения получают переработкой берилла в гидроокись Be (OH)2 или сульфат BeS04. По одному из способов, измельченный берилл спекают с Na2SiF6, образующиеся фторбериллаты натрия Na2BeF4 и NaBeF3 выщелачивают из смеси водой; при добавлении к этому раствору NaOH в осадок выпадает Be (OH)2. По другому способу, берилл спекают с известью или мелом, спек обрабатывают серной кислотой; образующийся BeS04 выщелачивают водой и осаждают аммиаком Be (OH)2. Более полная очистка достигается многократной кристаллизацией BeSO4, из которого прокаливанием получают BeO. Известно также вскрытие берилла хлорированием или действием фосгена. Дальнейшая обработка ведётся с целью получения BeF2 или BeCl2.
Металлический бериллий получают восстановлением BeF2 магнием при 900—1300°С или электролизом BeCl2 в смеси с NaCI при 350°С.
Полученный металл переплавляют в вакууме. Металл высокой чистоты получают дистилляцией в вакууме, а в небольших количествах — зонной плавкой; применяют также электролитическое рафинирование.
Из-за трудностей получения качественных отливок заготовки для изделий из бериллия готовят методами порошковой металлургии. Бериллий измельчают в порошок и подвергают горячему прессованию в вакууме при 1140—1180°С. Прутки, трубы и др. профили получают выдавливанием при 800—1050°С (горячее выдавливание) или при 400—500 °С (тёплое выдавливание). Листы из бериллия получают прокаткой горячепрессованных заготовок или выдавленных полос при 760—840°С. Применяют и др. виды обработки — ковку, штамповку, волочение. При механической обработке бериллия пользуются твердосплавным инструментом.
Сочетание малой атомной массы, малого сечения захвата тепловых нейтронов (0,009 барн на атом) и удовлетворительной стойкости в условиях радиации делает бериллий одним из лучших материалов для изготовления замедлителей и отражателей нейтронов в атомных реакторах. В бериллии выгодно сочетаются малая плотность, высокий модуль упругости, прочность, теплопроводность. По удельной прочности бериллий превосходит все металлы. Благодаря этому в конце 50 — начале 60-х гг. бериллий стали применять в авиационной, ракетной и космической технике и гироприборостроении. Однако высокая хрупкость бериллия при комнатной температуре — главное препятствие к его широкому использованию как конструкционного материала.
Бериллий входит в состав сплавов на основе Al, Mg, Cu и др. цветных металлов (см. Алюминиевые сплавы, Магниевые сплавы, Медные сплавы).
Некоторые бериллиды тугоплавких металлов рассматриваются как перспективные конструкционные материалы в авиа- и ракетостроении. Бериллий применяется также для поверхностной бериллизации стали. Из бериллия изготовляют окна рентгеновских трубок, используя его высокую проницаемость для рентгеновских лучей (в 17 раз большую, чем у алюминия). Бериллий применяется в нейтронных источниках на основе радия, полония, актиния, плутония, т.к. он обладает свойством интенсивного излучения нейтронов при бомбардировке a-частицами. Бериллий и некоторые его соединения рассматриваются как перспективное твёрдое ракетное топливо с наиболее высокими удельными импульсами.
Широкое производство чистого бериллия началось после 2-й мировой войны. Переработка бериллия осложняется высокой токсичностью летучих соединений и пыли, содержащей бериллий, поэтому при работе с бериллием и его соединениями нужны специальные меры защиты.
Бериллий в организме. Бериллий присутствует в тканях многих растений и животных. Содержание бериллия в почвах колеблется от 2•10-4 до 1•10-3%; в золе растений около 2•10-4%. У животных бериллий распределяется во всех органах и тканях; в золе костей содержится от 5.10-4 до 7.10-3% бериллия. Около 50% усвоенного животным бериллия выделяется с мочой, около 30% поглощается костями, 8% обнаружено в печени и почках. Биологическое значение бериллия мало выяснено; оно определяется участием бериллия в обмене Mg и Р в костной ткани. При избытке в рационе бериллия, по-видимому, происходит связывание в кишечнике ионов фосфорной кислоты в неусвояемый фосфат бериллия. Активность некоторых ферментов (щелочной фосфатазы, аденозинтрифосфатазы) тормозится малыми концентрациями бериллия. Под влиянием бериллия при недостатке фосфора развивается не излечиваемый витамином D бериллиевый рахит, встречаемый у животных в биогеохимических провинциях, богатых бериллием.
Лит.: Бериллий, под ред. Д. Уайта, Дж. Бёрка, пер. с англ., М., 1960; Дарвин Дж., Баддери Дж., Бериллий, пер. с англ., М., 1962; Силина Г. Ф., Зарембо Ю. И., Бертина Л. Э., Бериллий, химическая технология и металлургия, М., 1960; Папиров И. И., Тихинский Г. Ф., Физическое металловедение бериллия, М., 1968; Эверест Д., Химия бериллия, пер. с англ., М., 1968; Химия и технология редких и рассеянных элементов, т. 2, М., 1969; Самсонов Г. В., Химия бериллидов, «Успехи химии», 1966, т. 35, в. 5, с. 779; Гагарин В. В., Бериллий как конструкционный материал атомной энергетики, «Атомная техника за рубежом», 1969, №3, с.9; Ижванов Л. А. [и др.], Бериллий — новый конструкционный металл, «Металловедение и термическая обработка металлов», 1969, №2, с. 24; Коган Б. И., Капустинская К. А., Бериллий в современной технике, «Цветные металлы», 1967, № 7, с. 105.
Б. М. Булычев, Л. А. Ижванов, В. В. Ковальский.
