Берклий
БЕРКЛИЙ (от Беркли, Berkeley - город в США, где был открыт берклий; лат. Berkelium) Bk, искусственный радиоактивный хим. элемент III гр. периодич. системы; ат. н. 97; относится к актиноидам. Стабильных изотопов не имеет. Получены 10 изотопов с мае. ч, 240-251 (кроме 241). Наиб. долгоживущие: 247Bk (Т1/2 1380 лет;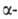 излучатель); 249Bk (Т1/2 314 сут;
излучатель); 249Bk (Т1/2 314 сут;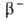 -излучатель). Конфигурация внеш. электронных оболочек атома 5f86s26p6d17s2; степени окисления +3 (наиб. устойчива), Ч-4; энергия ионизации Bk° -> Bk3+ 40,8 эВ; электроотрицательность по Полингу 1,0-1,2; ионные радиусы Bk3+ 0,0935 нм, Bk4+ 0,0870 нм.
-излучатель). Конфигурация внеш. электронных оболочек атома 5f86s26p6d17s2; степени окисления +3 (наиб. устойчива), Ч-4; энергия ионизации Bk° -> Bk3+ 40,8 эВ; электроотрицательность по Полингу 1,0-1,2; ионные радиусы Bk3+ 0,0935 нм, Bk4+ 0,0870 нм.
Берклий - серебристо-белый металл. Существует в двух модификациях: с гранецентрированной кубич. решеткой (a = = 0,4997 нм) и двойной гексагональной типа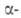 La (a — = 0,3416 нм, с = 1,1069 нм, z = 2); т-ра полиморфного перехода ок. 980°С; т. пл. ок. 1050°С, т. кип. ок. 2630°С; плотн. 14,8 г/см3. Св-ва изучались с использованием микрограммовых кол-в 249Bk.
La (a — = 0,3416 нм, с = 1,1069 нм, z = 2); т-ра полиморфного перехода ок. 980°С; т. пл. ок. 1050°С, т. кип. ок. 2630°С; плотн. 14,8 г/см3. Св-ва изучались с использованием микрограммовых кол-в 249Bk.
Берклий очень реакционноспособен, по хим. св-вам близок к Тb. Диоксид BkO2 (кубич. решетка) получают сжиганием на воздухе при 1250°С ионита, на к-ром сорбированы ионы Bk3+ . При восстановлении BkO2 водородом при 600°С образуется сесквиоксид Bk2O3 (кубич. решетка), при нагревании и послед, быстром охлаждении образуется гексагон. модификация. На воздухе при 600°С Bk2O3 окисляется до ВkO2. Тригалогениды BkHal3 (см. табл.) получают взаимод. Bk2O3 с HHal при 500-600°С, тетрафториД BkF4 -фторированием Bk2O3 элементным фтором при 400°С; синтезированы также оксогалогениды ВkOС1 и BkOBr.
Сульфид получают по р-ции: Bk2O3 + CS2 + H2S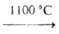 Bk2S3 + CO2 + H2O. Известны также гидроксид Bk(OH)3, сульфидоксид Bk2O2S2, нитрид BkN, фосфид BkP, арсенид BkAs, гидриды ВkH2+x. (х < 1) и нек-рые орг. производные. В расплавах Bk3 + способен восстанавливаться до Bk2+.
Bk2S3 + CO2 + H2O. Известны также гидроксид Bk(OH)3, сульфидоксид Bk2O2S2, нитрид BkN, фосфид BkP, арсенид BkAs, гидриды ВkH2+x. (х < 1) и нек-рые орг. производные. В расплавах Bk3 + способен восстанавливаться до Bk2+.
СВОЙСТВА ГАЛОГЕНИДОВ БЕРКЛИЯ
| Соединение | Цвет | Кристалл ич. решетка | Параметры решетки, нм | ||
| а | Ь | с | |||
| BkF3 | Желто-зеленый | Орторомбич., | 0,670 | 0,709 | 0,441 |
| гексаген. | 0,697 | — | 0,714 | ||
| BkCl3 | Зеленый | Гексагон. | 0,7382 | — | 0,4127 |
| BkBr3 | Желто-зеленый | Орторомбич. | 0,1260 | 0,4100 | 0,9100 |
| BkI3 | Желтый | Гексагон. | 0,750 | — | 0,204 |
| BkF4 | Светло-коричневый | Орторомбич. | 0,1247 | 0,1058 | 0,8170 |
Нитраты, хлориды, бромиды, сульфаты, перхлораты и сульфиды берклия раств. в воде. В водных р-рах берклий существует в виде ионов Bk3 + и Bk4 + . Для Bk3 +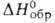 -712 кДж/моль,
-712 кДж/моль,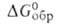 -699 кДж/моль, So298 170 Дж/(моль*), энтальпия и энтропия гидратации соотв. —49,2 кДж/моль и 369 Дж/(моль*К). Стандартный электродный потенциал Bk°/Bk3+ 2,4В, пары Bk3+/Bk4+ -1,62 В. Из водных р-ров Bk3+ соосаждается с LaF3 и La(OH)3. Ион Bk4+ м. б. получен окислением Bk3+ в кислой среде висмутатом Na, KBrO3, O3, AgO, (NH4)2S2O8 или его смесью с AgNO3, K2Cr2O7, PbO2, Na4XeO6, а также электрохим. окислением. Из р-ра Bk4+ м. б. выделен соосаждением с фосфатом Zr или Се(IO3)4.
-699 кДж/моль, So298 170 Дж/(моль*), энтальпия и энтропия гидратации соотв. —49,2 кДж/моль и 369 Дж/(моль*К). Стандартный электродный потенциал Bk°/Bk3+ 2,4В, пары Bk3+/Bk4+ -1,62 В. Из водных р-ров Bk3+ соосаждается с LaF3 и La(OH)3. Ион Bk4+ м. б. получен окислением Bk3+ в кислой среде висмутатом Na, KBrO3, O3, AgO, (NH4)2S2O8 или его смесью с AgNO3, K2Cr2O7, PbO2, Na4XeO6, а также электрохим. окислением. Из р-ра Bk4+ м. б. выделен соосаждением с фосфатом Zr или Се(IO3)4.
Берклий образует более прочные, чем РЗЭ, комплексы с С1-. На способности Bk3+ к комплексообразованию, напр. с NCS- или цитрат-ионами, основано его отделение от др. актиноидов и РЗЭ. Так, Bk3+ экстрагируется бензолом в виде внутрикомплексного соединения с теноилтрифторацетоном при рН 4 в 10-15 раз эффективнее, чем Аm3+ и Ст3+.
Изотоп 249Bk образуется в ядерных реакторах при длительном интенсивном облучении нейтронами плутониевых или кюриевых мишеней в результате многократного захвата нейтронов. Этим путем в США получают ок. 20 мг 249Bk в год. Изотоп 247Bk образуется при бомбардировке кюриевых мишеней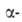 частицами, ускоренными на циклотроне. Выделение берклия из материалов облученных мишеней включает: отделение Am; осаждение Cm, Bk, РЗЭ, Pu и остаточного кол-ва Am в виде фторидов; превращение фторидов в гидроксиды; растворение и перевод гидроксидов в хлораты; хроматографич. разделение хлоратов на катионите с использованием в кач-ве элюентов р-ров цитрата аммония, молочной или
частицами, ускоренными на циклотроне. Выделение берклия из материалов облученных мишеней включает: отделение Am; осаждение Cm, Bk, РЗЭ, Pu и остаточного кол-ва Am в виде фторидов; превращение фторидов в гидроксиды; растворение и перевод гидроксидов в хлораты; хроматографич. разделение хлоратов на катионите с использованием в кач-ве элюентов р-ров цитрата аммония, молочной или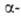 гидроксиизомасляной к-т. Применяют метод, включающий растворение гидроксидов в HNO3 и перевод Bk3+ в Bk4+ с одноврем. жидкостной экстракцией его трибутилфосфатом, что позволяет отделить берклий от лантаноидов и др. актиноидов в степени окисления + 3. Реэкстракцией р-ром (N2H5)C1 или (NH3OH)C1 получают продукт, содержащий 92% Bk и 8% Am. Транскюриевые элементы м. б. отделены от Pu, Am и Cm экстракцией их из разб. солянокислых р-ров р-ром 2-этилгексилфенилфосфорной к-ты в диэтилбензоле. При реэкстракции разбавленной соляной к-той количественно разделяются Bk и Cf.
гидроксиизомасляной к-т. Применяют метод, включающий растворение гидроксидов в HNO3 и перевод Bk3+ в Bk4+ с одноврем. жидкостной экстракцией его трибутилфосфатом, что позволяет отделить берклий от лантаноидов и др. актиноидов в степени окисления + 3. Реэкстракцией р-ром (N2H5)C1 или (NH3OH)C1 получают продукт, содержащий 92% Bk и 8% Am. Транскюриевые элементы м. б. отделены от Pu, Am и Cm экстракцией их из разб. солянокислых р-ров р-ром 2-этилгексилфенилфосфорной к-ты в диэтилбензоле. При реэкстракции разбавленной соляной к-той количественно разделяются Bk и Cf.
В малых кол-вах 249Bk определяют радиометрич. методом - измерением общей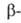 активности препарата после полной хим. и радиохим. очистки. Сравнительно большие кол-ва берклия могут быть определены измерением его
активности препарата после полной хим. и радиохим. очистки. Сравнительно большие кол-ва берклия могут быть определены измерением его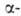 активности (с энергией 5,46 МэВ). Перспективны спектрофотометрич. методы определения с использованием орг. реагентов.
активности (с энергией 5,46 МэВ). Перспективны спектрофотометрич. методы определения с использованием орг. реагентов.
Изотопы берклия применяют для исследовательских работ в ядерной физике и радиохимии.
Берклий синтезирован С. Томпсоном, А. Гиорсо и Г. Сиборгом в 1949 бомбардировкой 241Аm2О3 высокоэнергетич. ионами Не [241 Am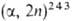 Bk]. Изотоп 243Bk в кол-ве ок. 0,4 мкг был получен Б. Каннингемом и С. Томпсоном в 1958. В виде металла берклий получили Дж. Петерсон, Дж. А. Фейни и С. Д. Бейларц только в 1970 путем восстановления BkF3 парами Li в тигле из тантала при 1000-1050 °С в глубоком вакууме.
Bk]. Изотоп 243Bk в кол-ве ок. 0,4 мкг был получен Б. Каннингемом и С. Томпсоном в 1958. В виде металла берклий получили Дж. Петерсон, Дж. А. Фейни и С. Д. Бейларц только в 1970 путем восстановления BkF3 парами Li в тигле из тантала при 1000-1050 °С в глубоком вакууме.
Лит. см. пру ст. Актиноиды. Б. В. Громов.
