Рубидий
РУБИДИЙ (от лат. rubidus-красный; rubidium) Rb, хим. элемент I гр. периодич. системы, ат. н. 37, ат. м. 85,4678; относится к щелочным металлам. В природе встречается в виде смеси стаб. изотопа 85Rb (72,15%) и радиоактивного 87Rb (27,85%; Т1/2 4,8·1010лет, b-излучатель). Поперечное сечение захвата тепловых нейтронов для прир. смеси 0,73·10-28 м2. Конфигурация внеш. электронной оболочки атома 5s1; степень ркисления +1; энергии ионизации Rb0 : Rb+ : Rb2+ 4,17719 эВ, 27,5 эВ; сродство к электрону 0,49 эВ; электроотрицательность по Полингу 0,8; работа выхода электрона 2,16 эВ; металлич. радиус 0,248 нм, ко-валентный радиус 0,216 нм, ионный радиус Rb+ 0,166 нм (координац. число 6), 0,186 нм (12).
Содержание рубидия в земной коре 1,5·10-2% по массе. Собств. минералов не образует, в природе находится в рассеянном состоянии. Встречается в виде примеси в минералах К (карналлите и сильвине) и в богатых К алюмосиликатах-лепидолите, циннвальдите, биотите, амазоните, петалите и др., а также в трифилине; присутствует в минералах Cs-поллу-ците и редком авогадрите; находится в минер. источниках, озерной, морской и подземных водах. Осн. пром. запасы рубидия сконцентрированы в лепидолите (0,09-3% по массе в расчете на Rb2O), циннвальдите (0,16-1,7%), поллуците (0,3-1,2%), карналлите (0,015-0,040% по массе в расчете на RbCl). Перспективные сырьевые источники рубидия-нефелиновые руды (0,02-0,03% по массе Rb2O), биотит (0,06-0,4%), флогопит (0,04-0,2%) и нек-рые др. слюды и слюдяные хвосты, получаемые на обогатит. фабриках при разработке берилловых и флюоритовых месторождений, а также прир. высокоминерализов. воды.
Свойства. Рубидий-мягкий серебристо-белый металл, при обычной т-ре имеет почти пастообразную консистенцию, пары окрашены в зеленовато-синий цвет. Кристаллизуется в объемноцентрир. кубич. решетке, а — 0,570 нм, z = 2, пространств. группа Iт3т. Т.пл. 39,32 °С, т. кип. 687,2 °С; плотн. 1,532 г/см3 (0°С), 1,4718 г/см3 (687,2 °С); 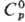 31,1 Дж/(моль·К);
31,1 Дж/(моль·К);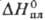 2,19 кДж/моль,
2,19 кДж/моль, 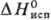 70 кДж/моль, 80,9
70 кДж/моль, 80,9 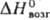 кДж/моль;
кДж/моль; 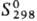 76,8 Дж/(моль·К); ур-ния температурной зависимости давления пара: lgp (ммрт.ст.) = — 4296/Т+ 6,619 — - 0,8541g Т+ 2863Т (100-312 К), lgp (ммрт.ст.) = = -4006/Т+ 6,154 - 0,309 lgT(312-955 К); теплопроводность [Вт/(м·К)] 35,6 (293 К), 31,41 (323 К), 34,35 (493 К); температурный коэф. линейного расширения 9·10-5K-1 (273-303 К); r (мкОм·м) 0,1125 (273 К), 0,1351 (312 К, твердый), 0,2153 (312 К, жидкий), 0,2906 (400 К), 0,4762 (600 К), температурный коэф. r 4,7·10-3 К-1 (273-293 К) при плавлении возрастает в 1,6 раза; уд. магн. восприимчивость + 0,198·10-9 (303-373 К); g 92,63 мН/м (313 К); давление истечения 0,78 МПа (295 К); h (мПа·с) 6,43 (312,47 K), 4,37 (400 К), 1,69 (900 К). Твердость по Моосу 0,3; модуль упругости 2,35 ГПа; сжимаемость 40,5·10-11 Па-1.
76,8 Дж/(моль·К); ур-ния температурной зависимости давления пара: lgp (ммрт.ст.) = — 4296/Т+ 6,619 — - 0,8541g Т+ 2863Т (100-312 К), lgp (ммрт.ст.) = = -4006/Т+ 6,154 - 0,309 lgT(312-955 К); теплопроводность [Вт/(м·К)] 35,6 (293 К), 31,41 (323 К), 34,35 (493 К); температурный коэф. линейного расширения 9·10-5K-1 (273-303 К); r (мкОм·м) 0,1125 (273 К), 0,1351 (312 К, твердый), 0,2153 (312 К, жидкий), 0,2906 (400 К), 0,4762 (600 К), температурный коэф. r 4,7·10-3 К-1 (273-293 К) при плавлении возрастает в 1,6 раза; уд. магн. восприимчивость + 0,198·10-9 (303-373 К); g 92,63 мН/м (313 К); давление истечения 0,78 МПа (295 К); h (мПа·с) 6,43 (312,47 K), 4,37 (400 К), 1,69 (900 К). Твердость по Моосу 0,3; модуль упругости 2,35 ГПа; сжимаемость 40,5·10-11 Па-1.
Рубидий обладает высокой реакц. способностью. Стандартный электродный потенциал —2,925 В. В О2 и на воздухе мгновенно окисляется с воспламенением, образуя надпероксид RbO2 с примесью пероксида Rb2O2. При ограниченном доступе О2 окисляется до оксида Rb2O. С водой реагирует обычно со взрывом с образованием гидроксида RbOH и выделением Н2. Взаимод. с сухим Н2 при нагр. под давлением 5-10 МПа в присут. катализатора с образованием гидрида RbH. Непосредственно соединяется с галогенами, давая рубидия галогениды. Образование сульфида Rb2S при растирании рубидия с порошком S сопровождается взрывом. При сплавлении рубидия в вакууме с Se и Те получают соотв. селенид Rb2Se и теллурид Rb2Te. С N2 в обычных условиях не взаимод., с жидким N2 в электрич. разряде между электродами, изготовленными из рубидия, образует нитрид Rb3N. Рубидий раств. в жидком NH3, алкиламинах и нек-рых полиэфирах, давая синие р-ры, содержащие сольватир. электроны и обладающие электронной проводимостью. С сухим газообразным NH3 рубидий при 200-300 РС образует амид RbNH2, с красным P при 400-430 °С-фосфид Rb2P5, с порошком графита при 200-350 °С- карбид C8Rb, а при более высоких T-pax-C24Rb, с ацетиленом - ацетиленид Rb2C2, с Si и Ge в атмосфере Аг при 600 °С-соотв. силицид RbSi и германид RbGe. Рубидий взаимод. с СО2, ССl4 и СНСl3 со взрывом, выше 300 °С разрушает стекло, восстанавливая SiO2 и силикаты до Si. Рубидий реагирует со всеми к-тами, в т. ч. с орг., с образованием соответствующих солей, со спиртами дает алкоголяты. Св-ва соединений рубидия представлены в таблице.
Рубидий образует сплавы со щелочными металлами, состоящие из твердых р-ров (с К и Cs), расслаивающихся компонентов (с Li) или содержащие эвтектич. смеси (с Na). Интерметаллиды существуют в системах рубидия со мн. металлами-Аu, Hg, Cd, Ga, In, Sn, Pb, Bi и др., исключая тугоплавкие металлы.
Получение. Рубидий извлекают при переработке минер. сырья на др. ценные компоненты. Получаемые концентраты рубидия содержат также соед. К (в превосходящем кол-ве) и Cs. Далее проводят хим. обогащение концентрата с получением техн. соединений рубидия и очистку последних от примесей соед. К и Cs.
Большую часть рубидия получают при переработке лепидолита на соед. Li. Рубидий осаждают из маточных р-ров (после выделения Li2CO3 или LiOH) в виде смеси алюморубидиевых, алюмокалиевых и алюмоцезиевых квасцов общей ф-лы MAl(SO4)2· 12H2O. Смесь разделяют методом фракционир. кристаллизации. Др. источник рубидия-отработанный электролит, получающийся при переработке карналлита на Mg. Из него рубидий выделяют сорбцией на осадках ферроцианидов Fe или Ni; далее ферроцианиды прокаливают и получают Rb2CO3 с примесями К и Cs. Более эффективна сорбция на гранулир. ферроцианидах в хроматографич. колонках с послед. элюированием водным р-ром NH4C1. При переработке поллуцита на соед. цезия рубидий извлекают из маточных р-ров после осаждения Cs3[Sb2Cl9]. Возможно извлечение рубидия из технол. р-ров переработки нефелина на глинозем.
Перспективен метод извлечения рубидия ионообменной хроматографией на синтетич. смолах и неорг. ионитах (кли-ноптилолит, глауконит, фосфаты Zr), а также экстракцией производными фенола [4-втор-бутил-2-(a-метилбензил)фе-нол, алкилфенолы С7—С9 и др.]. Для получения соединений рубидия высокой чистоты используют его полигалогениды.
Металлический рубидий получают в осн. восстановлением RbHal магнием или кальцием (600-800 °С, ~ 0,1 Па) с послед, очисткой от примесей ректификацией и вакуумной дистилляцией. Можно получить рубидий электрохим. способом из расплава RbHal на жидком свинцовом катоде, из образовавшегося свинцово-рубидиевого сплава рубидий выделяют дистилляцией в вакууме. В небольших кол-вах рубидий получают восстановлением Rb2CrO4 порошком Zr или Si, а рубидий высокой чистоты-путем медленного термич. разложения RbN3 в вакууме (менее 0,1 Па) при 390-395 °С.
Определение. Качественно рубидий обнаруживают по очень яркой спектральной линии 780,023 нм, в отсутствие К и Cs-также по образованию RbClO4, Rb2[PtCl6], Rb2[SnI6], RbOC6H2(NO2)3. Количественно рубидий определяют в осн. методами фотометрии пламени или атомно-абсорбц. спектроскопии по резонансным линиям 780,023 и 794,760 нм. Применяют также радиохим. метод изотопного разбавления и нейтронно-активационный. Хим. методы количеств. определения рубидия требуют предварит. удаления К и Cs. В отсутствие К и Cs рубидий определяют гравиметрически в форме RbCl04, Rb2[PtCl6], Rb[B(C6H5)4], а также титриметри-чески.
Применение. Металлический рубидий-компонент материала катодов для фотоэлементов и фотоэлектрич. умножителей, геттер в вакуумных лампах, входит в состав смазочных композиций, используемых в реактивной и космич. технике, применяется в гидридных топливных элементах, катализатор. Пары рубидия используют в разрядных электрич. трубках, лампах низкого давления - источниках резонансного излучения, в чувствит. магнитометрах, стандартах частоты и времени. Перспективно использование рубидия в качестве ме-таллич. теплоносителя и рабочей среды в ядерных реакторах и турбоэлектрич. генераторных установках. Соединения рубидия-компоненты спец. стекол и керамики, Rb2O входит в состав сложных фотокатодов.
Мировое произ-во рубидия и его соед. (без СНГ) ок. 450 кг/год (1979).
Рубидий опасен в обращении, хранят его в ампулах из стекла пирекс в атмосфере Аr или в стальных герметичных сосудах под слоем обезвоженного масла (вазелинового, парафинового). Утилизируют рубидий обработкой остатков металла пентанолом.
Рубидий открыли в 1861 Р. Бунзен и Г. Кирхгоф.
Лит.: Коган Б. И., Названова В. А., Солодов H. А., Рубидий и цезий, М., 1971; Плющев В. Е., Степин Б. Д., Аналитическая химия рубидия и цезия, М., 1975. См. также лит. при ст. Литий. Л. И. Покровская.
