2.7.3. Нуклеофильные реакции карбонильных соединений
Реакции нуклеофильного присоединения и замещения карбонильных соединений играют важную роль в химии и биологии. В частности, к ним относятся реакции образования пептидных связей в условиях биосинтеза белка. Обычно эти реакции идут в водной среде. При этом растворитель играет роль резервуара, с которым происходит обмен протонами. Поэтому при подходе нуклеофильного реагента NuH к карбонильному соединению XCOY возможно образование интермедиатов с разным характером протонирования:
Наименее устойчивым является интермедиат Т±. До настоящего времени его не удалось обнаружить экспериментально, и вывод о том, что он существует, сделан на основе косвенных данных. Для решения этого вопроса в работах [130, 131] рассчитан профиль потенциальной энергии для простейшей модельной реакции
NH3 + Н2СО ↔ H3N+—СH2—О-. (VI)
Расчеты проведены и неэмпирическими, и полуэмпирическими (рис. 2.5) методами. По данным неэмпирических расчетов биполярный интермедиат в газовой фазе существовать не может. Полуэмпирический метод МПДП привел к такому же результату, причем профили потенциальной энергии, вычисленные неэмпирическим методом (в расширенных базисах) и методом МПДП, получились почти одинаковыми. Все остальные полуэмпирические методы (ППДП/2, ППДП/БУ, МЧПДП/2, МЧПДП/3) привели к противоположному результату. Данные неэмпирических расчетов являются более надежными, поэтому в работах [130, 131] был сделан вывод о том, что биполярный интермедиат в газовой фазе существовать не может и из полуэмпирических методов только метод МПДП дает правильный результат.
Метод МПДП был использован для дальнейшего исследования профиля потенциальной энергии реакции (VI) в растворах. Сольватация моделировалась в приближении супермолекулы. Полученные результаты приведены на рис. 2.6. Видно, что включение в реакционную систему четырех молекул воды достаточно для появления локального минимума в случае биполярного интермедиата. Этот результат показывает, что в полярных растворителях биполярный интермедиат может существовать.
Рис. 2.5. Сечения ППЭ для реакции присоединения аммиака к формальдегиду с образованием биполярного интермедиата:а - расчеты полуэмпирическими методами: 1 - МПДП; 2 - МЧПДП/2; 3 - МЧПДП/2; 4 -МЧПДП/3; 5 - ППДП/БУ; 6 - ППДП/2; б - расчеты неэмпирическими методами: 1 - ОСТ-ЗГФ; 2 - 4-31ГФ; 3 - 6-31ГФ; 4 - 6-31ГФ*.
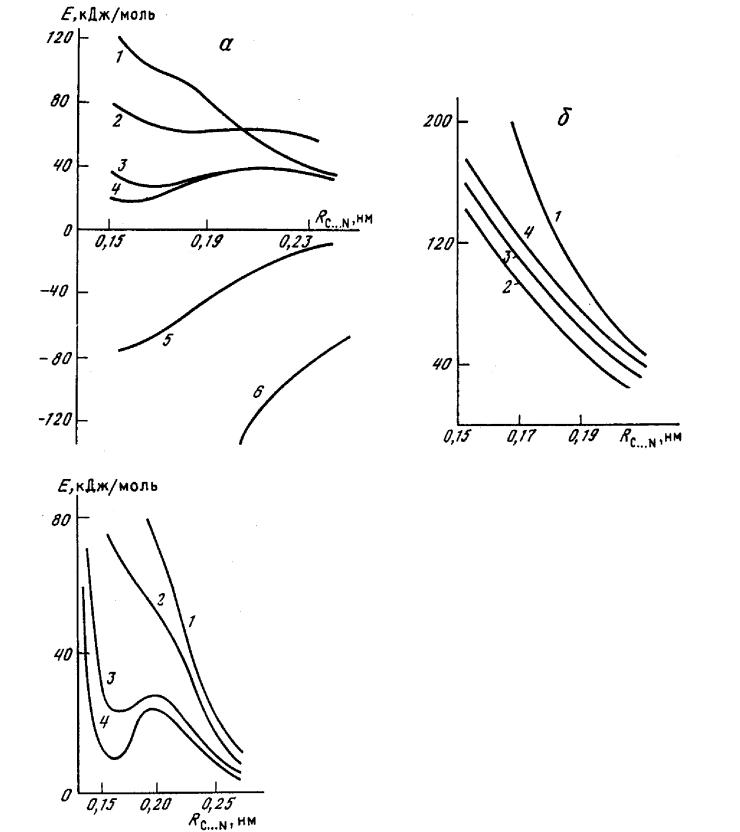
Рис. 2.4. Влияние гидратации на сечение ППЭ реакции присоединения аммиака к формальдегиду с образованием биполярного интермедиата: 1 — расчет для газовой фазы; 2 - 4 — гидратация моделировалась двумя (2), четырьмя (3) и шестью (4) молекулами воды.
Таким образом, неэмпирические методы были использованы [130, 131] для расчета термодинамических параметров простейшей модельной системы и решения вопроса, какой из полуэмпирических методов правильно передает профиль потенциальной энергии. После того как было установлено, что метод МПДП дает правильные результаты, им были проведены вычисления для более сложной системы с несколькими молекулами воды. Такое сочетание полуэмпирических и неэмпирических расчетов, с нашей точки зрения, является наиболее разумным.
При изучении механизмов многих органических реакций кванто-вохимическими методами необходимо учитывать взаимодействие реагентов и растворителей. Это утверждение в первую очередь относится к ион-молекулярным реакциям. При решении прикладных задач мы часто имели дело с реакциями такого типа и на большом числе примеров убедились, что результаты квантовохимических расчетов для газофазных моделей нельзя использовать для рассмотрения этих реакций в растворах, так как сольватация качественно меняет вычисленный профиль потенциальной энергии.
Для учета сольватации в настоящее время наиболее широко применяются метод Монте-Карло с атом-атомными потенциалами, приближение супермолекулы и модель точечных диполей. Все эти методы качественно правильно передают изменение профиля потенциальной энергии ион-молекулярных реакций при переходе из газовой фазы в раствор. Метод Монте-Карло дает, по-видимому, наиболее достоверные результаты, но его использование для вычисления потенциальных профилей органических реакций в полярных растворителях требует очень больших затрат машинного времени и для реальных реакций практически невозможно.
Приближение супермолекулы используют для изучения влияния сольватации на реакционную способность органических соединений лишь в случае растворителей, молекулы которых содержат небольшое число атомов. Таким растворителем, в частности, является вода. Присоединение к реагентам нескольких молекул воды позволяет понять, как влияет полярный растворитель на профиль потенциальной энергии органической реакции.
Модель точечных диполей также может быть использована для изучения влияния сольватационных эффектов на реакционную способность органических соединений. Она дает менее точные результаты, но вполне пригодна для изучения сольватационных эффектов на качественном уровне. Эта модель необычайно экономична, поэтому при решении большинства прикладных задач мы рекомендуем отдавать предпочтение именно ей. Более сложными моделями следует пользоваться лишь в исключительных случаях.


