Механизм действия липофильных гормонов
А. Механизм действия липофильных гормонов
К липофильным сигнальным веществам принадлежат все стероидные гормоны, тироксин и ретиноевая кислота. Местом действия этих биорегуляторов являются ядра клеток-мишеней.
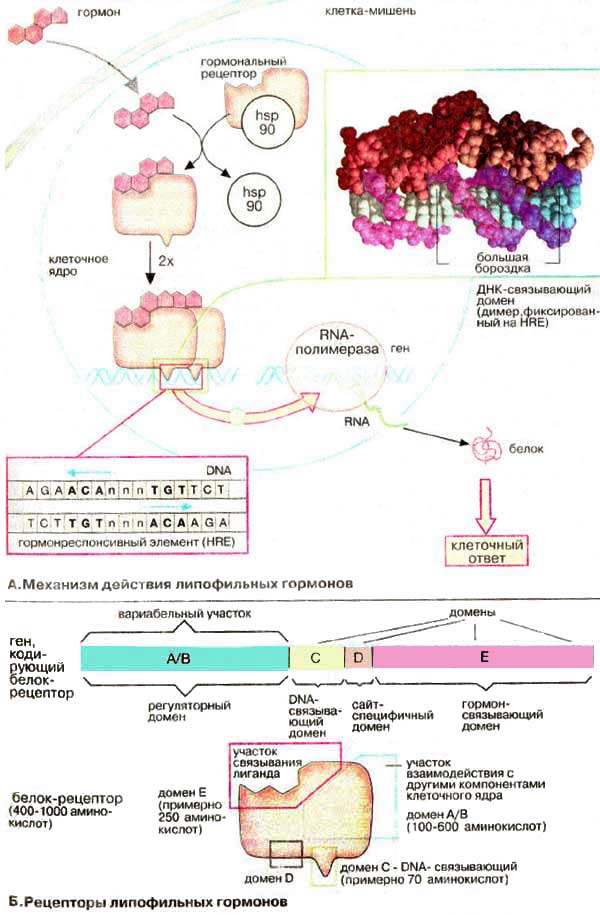
В крови липофильные гормоны обычно бывают связаны с транспортными белками крови. Однако через плазматическую мембрану проникает лишь свободный гормон. В цитоплазме или в клеточном ядре гормон взаимодействует со специфическим рецептором.
Рецепторы гормонов принадлежат к группе редких белков. Они присутствуют в клетках-мишенях в количестве 103 - 104 молекул на клетку и вместе с тем характеризуются высоким уровнем сродства к гормону (Кd = 10-8 - 10-10 М) и высокой избирательностью. Связывание гормона влечет за собой конформационную перестройку молекулы рецепторного белка, сопряженного с другими белками, диссоциацию с освобождением от белков-ингибиторов, в частности от белка теплового шока (hsp90), и образование димеров, обладающих повышенным сродством к ДНК (DNA).
Ключевой стадией процесса гормональной регуляции является связывание димеров гормон-рецепторного комплекса с двунитевой ДНК. Комплекс связывается с регуляторными участками генов, которые носят название гормон-респонсивные элементы [ГРЭ (HRE)]. Это короткие симметричные фрагменты ДНК (палиндромы, см. рис. 255), которые выполняют функции усилителей (энхансеров, англ. enhancer) транскрипции. На схеме приведен ГРЭ для глюкокортикоидов (n — любой нуклеотид). ГРЭ для других гормонов имеют несколько иную нуклеотидную последовательность, что существенно важно для сохранения специфичности гормонального действия. Каждый гормон-рецепторный комплекс узнает собственный участок связывания и инициирует транскрипцию лишь одного контролируемого этим участком гена. Связывание димеров рецептора с ГРЭ ведет к стимуляции, реже — к ингибированию, транскрипции соседних генов. Так, действие гормона в течении нескольких часов приводит к изменению уровня специфических мРНК ключевых белков клетки.
Б. Рецепторы липофильных гормонов
Рецепторы липофильных сигнальных веществ во многом сходны, так как принадлежат к одному семейству белков. Молекула рецепторного белка включает несколько доменов. имеющих различные размеры и выполняющих разные функции. В молекуле имеется регуляторный и ДНК-связывающий домены, а также небольшой сайт-специфичный и гормонсвязывающий домены. Наибольшая степень гомологии между рецепторами наблюдается в области ДНК-связывающего домена. В этом домене содержатся повторяющиеся фрагменты, богатые остатками цистеина. Цистеин может координационно связывать ионы цинка и, следовательно, образовывать цинковые кластеры.
Наряду с рецепторами стероидных гормонов, тироксина (и других тиреоидных гормонов) и ретиноевой кислоты семейство цинксодержащих белков включает вирусный и клеточный онкоген erb-A, рецептор экологически опасного токсина диоксина и множество других белков, лиганды которых пока не идентифицированы.
С помощью химического синтеза получают вещества, не идентичные гормонам, но обладающие свойством связываться с рецепторами. Синтетические лиганды, вызывающие тот же эффект, что и природные гормоны, называются агонистами гормонов. Например, синтетическим путем получены оральные контрацептивы, агонисты эстрогенов и прогестерона. Лиганды, которые связываются с рецептором, но не вызывают биологического эффекта, носят название антагонистов, т. е. антагонисты блокируют действие эндогенных гормонов. Антагонисты гормонов находят применение в терапии опухолей. Для того чтобы оценить, является ли данная опухоль гормонозависимой и будет ли она чувствительна к действию антагонистов, необходимо на пробе ткани определить уровень экспрессии гормональных рецепторов.


