Нитрила соединения
НИТРИЛА СОЕДИНЕНИЯ, неорг. соед., содержащие группу NO 2 или катион NO2, называемый нитронием или нитрилом. В орг. химии нитрилы-это соед. с группой —C=N, группу же —NO2 наз. нитрогруппой, а соед., содержащие такую группу,-нитросоединениями. Комплексные соед. с нитрит-ионом, координированным к металлу через атом азота, напр. [Co(NH3)5NO2]2+ , наз. нитрокомплексами.
Известны нитрила соединения, в к-рых группа —NO, связана с атомами N (нитрамид NO2NH2), галогена (NO2X, где X = F, Cl, Вr). Н и т р и л ф т о р и д NO2F-6ecцв. газ; молекула плоская, длина связи N—О 0,11798 нм, N—F 0,1467 нм, угол ONO 136°, m 1,555.10-30Кл.м; т. пл. -165,9°С, т. кип. -72,31 °С; ур-ние температурной зависимости плотн. жидкости d = = 2,143-0,00323T г/см3; С0р 49,86 ДжДмоль•К); DH0обр -79,5 кДж/моль; S0298 260,14 Дж/(моль.К); разлагается выше 300 °С; окислитель и фторирующий агент; при р-ции о к-тами Льюиса образует соли нитрония. Получают NO2F фторированием NO2 посредством F2, AgF2, CoF3 и т.п. или р-цией N2O5 с NaF. В смеси с жидким HF нитрилфторид-перспективный р-ритель для металлов и их оксидов. Н и т р и л х л о р и д NO2Cl-бесцв. газ, в конденсир. состоянии окрашен в желтый цвет; т. пл. —141 °С, т. кип. -14,3°С; плотн. при -45 °С 1,520 г/см3; С0р 53,4 Дж/(моль.К); DH0обр 26,4 кДж/моль; S0298 272,1 Дж/(моль.К); разлагается на NO2 и Сl2 выше 180°С; взаимод. с к-тами Льюиса и оксидами неметаллов, давая соли нитрония и нитрозония, напр.:
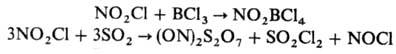
Получают NO2Cl действием HSO3Cl на HNO3.
Катион NO2+ имеет линейное строение, длина связи N—О 0,110 нм; положит. заряд сосредоточен в осн. на атоме N. С о л и н и т р о н и я NO2 с анионами ВF-4 , PF-6 , SiF2-6, SbF-6, WF-7 при нагр. обратимо диссоциируют на NO2F и простые фториды, а соли NO2SO3F (т. пл. 218 °С), (NO2)2S2O7 (т. пл. 151°С), NO2S2O6F (т. пл. 130°С), NO2ClO4, NO2CF3SO3 разлагаются необратимо выше 100°С. В водном р-ре соли нитрония полностью гидролизуются с образованием двух к-т, из к-рых одна HNO3. В неводных средах (CH3CN, CH3NO2, POCl3 и др.) ион NO2 - более сильный окислитель, чем нитрозоний NO+ (потенциал ионизации молекулы NO2 9,78 эВ). Соли нитрония-нитрующие агенты в орг. химии, причем селективность нитрования повышается при использовании комплексов NO+2 с краун-эфирами.
При аммонолизе солей нитрония образуется н и т р а м и д NO2NH2—бесцв. гигроскопичные кристаллы; в молекуле NO2—H2N длина связи N—N 1,427 нм, N—О 0,1206 нм, угол ONO 130°, угол между плоскостями NH2 и NO2 51,5°; m 12,53•10-30 Кл.м; DH0обр -86,6 кДж/моль; возгоняется в вакууме, разлагается и одновременно плавится ок. 172°С, при этом происходит сильное тепловыделение, иногда вспышка. В водном р-ре NO2NH2 ведет себя как слабая одноосновная к-та (рКа 6,59), однако однозамещенные соли нитрамида не выделены, поскольку в щелочной среде он мгновенно распадается; известна только малостабильная соль Hg. В. Я. Росоловский.
