Электрокристаллизация
ЭЛЕКТРОКРИСТАЛЛИЗАЦИЯ, образование и рост кристаллов в объеме р-ра (расплава) или на пов-сти электрода в результате протекания электрохим. р-ции. Является фазовым переходом I рода. Имеет много общего с кристаллизацией из пара и р-ра, но в отличие от этого процесса в условиях электрокристаллизации происходит акт переноса заряда, к-рый предшествует встраиванию атомов в места роста кристаллов или протекает одновременно с ним.
Различают гомогенную и гетерогенную электрохим. нуклеацию, т. е. зарождение кристаллов новой фазы. Первая имеет место, напр., при восстановлении ионов в объеме р-ра с образованием коллоидных частиц, вторая - при восстановлении ионов на пов-сти электрода. Зарождению кристаллов на пов-сти электрода может предшествовать образование слоев адсорбир. атомов (адатомов) осаждаемого в-ва, чаще всего металла. Возникновение моноатомных (иногда двух- и трехатомных) слоев происходит при электродных потенциалах, на неск. десятков мВ положительнее равновесного. Степень заполнения пов-сти адсорбир. атомами влияет на скорость зарождения кристаллов новой фазы (число зародышей в единице объема, образующихся за единицу времени).
Зарождение кристаллов в условиях электрокристаллизации требует превышения электрохим. потенциала системы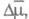 пропорционального перенапряжению
пропорционального перенапряжению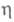 (см.. Поляризация);
(см.. Поляризация);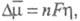 где п-число участвующих в р-ции электронов; F - постоянная Фарадея. Нуклеация в объеме р-ра или на пов-сти инертного электрода начинается путем образования трехмерных зародышей, т. е. частиц, размеры к-рых соизмеримы по всем кристаллографич. направлениям. Для малых
где п-число участвующих в р-ции электронов; F - постоянная Фарадея. Нуклеация в объеме р-ра или на пов-сти инертного электрода начинается путем образования трехмерных зародышей, т. е. частиц, размеры к-рых соизмеримы по всем кристаллографич. направлениям. Для малых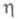 кинетика электрохим. нуклеации описывается классич. флуктуационной теорией, согласно к-рой в результате флуктуац. процессов присоединения и отрыва частиц в маточной среде возникает набор кластеров, распределенных по размерам (см. Зарождение новой фазы). Частоты присоединения и отрыва частиц для электрохим. систем определяются величиной
кинетика электрохим. нуклеации описывается классич. флуктуационной теорией, согласно к-рой в результате флуктуац. процессов присоединения и отрыва частиц в маточной среде возникает набор кластеров, распределенных по размерам (см. Зарождение новой фазы). Частоты присоединения и отрыва частиц для электрохим. систем определяются величиной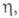 зависят от кривизны пов-сти кластеров и адсорбционных характеристик. Вероятность возникновения кластера данного размера определяется законом распределения Больцмана, а кинетика - частотами присоединения и отрыва частиц. Кластер, присоединение атома к к-рому делает его устойчивым к дальнейшему росту при данном перенапряжении, наз. критич. зародышем, работа образования к-рого для гомогенного зарождения равна:
зависят от кривизны пов-сти кластеров и адсорбционных характеристик. Вероятность возникновения кластера данного размера определяется законом распределения Больцмана, а кинетика - частотами присоединения и отрыва частиц. Кластер, присоединение атома к к-рому делает его устойчивым к дальнейшему росту при данном перенапряжении, наз. критич. зародышем, работа образования к-рого для гомогенного зарождения равна:
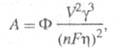
где Ф - фактор формы зародыша; V- молярный объем кристаллич. фазы;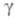 - уд. межфазная поверхностная энергия.
- уд. межфазная поверхностная энергия.
Соответственно скорость зарождения кристалла / при т-ре Т описывается ур-нием:
I = к ехр(-A/kT),
где k - постоянная Больцмана. Для систем с высокими значениями тока обмена (электроды из Ag, Pb, Hg) в небольших интервалах изменений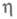 коэф. к остается постоянной величиной и наблюдается линейная зависимость lgI от
коэф. к остается постоянной величиной и наблюдается линейная зависимость lgI от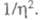 С ростом
С ростом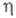 размер критич. зародыша уменьшается и при высоких
размер критич. зародыша уменьшается и при высоких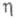 зародыш может состоять из единичных атомов. В этом случае использование значения
зародыш может состоять из единичных атомов. В этом случае использование значения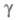 в ур-нии для А становится некорректным, кинетика электрохим. нуклеации описывается атомистич. теорией, согласно к-рой скорость образования зародышей и число атомов в зародыше дискретно изменяются с ростом
в ур-нии для А становится некорректным, кинетика электрохим. нуклеации описывается атомистич. теорией, согласно к-рой скорость образования зародышей и число атомов в зародыше дискретно изменяются с ростом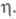 Число атомов в зародыше остается неизменным в нек-ром интервале значений
Число атомов в зародыше остается неизменным в нек-ром интервале значений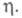
Критич. зародыши образуются на активных центрах пов-сти электрода. Такими центрами м. б. поры в оксидной пленке, выходы винтовых дислокаций, вакансии, изломы на ступенях роста и др. энергетич. неоднородности пов-сти. Число активных центров, участвующих в процессе электрохим. нуклеации, возрастает с увеличением
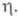 Вокруг возникшего и растущего кристалла образуются зоны экранирования ("дворики роста"), в к-рых нуклеации не происходит. Радиус зон экранирования уменьшается с ростом
Вокруг возникшего и растущего кристалла образуются зоны экранирования ("дворики роста"), в к-рых нуклеации не происходит. Радиус зон экранирования уменьшается с ростом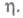 Постепенно происходит исчерпание числа свободных активных центров и прекращение зарождения новых кристаллов, наступает насыщение. Адсорбция примесей из р-ра на электроде снижает число активных центров и, соотв., общее число зародышей. Стадия зарождения кристаллов определяет в конечном итоге осн. физ.-мех. св-ва гальванич. покрытий, в т.ч. их пористость.
Постепенно происходит исчерпание числа свободных активных центров и прекращение зарождения новых кристаллов, наступает насыщение. Адсорбция примесей из р-ра на электроде снижает число активных центров и, соотв., общее число зародышей. Стадия зарождения кристаллов определяет в конечном итоге осн. физ.-мех. св-ва гальванич. покрытий, в т.ч. их пористость. На атомногладкой грани кристалла его рост происходит путем образования двумерного критич. зародыша и его последующего разрастания. Возникновение двумерного зародыша требует определенного перенапряжения
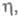 связанного с возникновением новой пов-сти - ступени роста и, соотв., избыточной краевой энергии. Распространение растущего слоя по пов-сти грани происходит тангенциально, путем присоединения атомов к местам роста (изломам на ступени). Такая электрокристаллизация наблюдается на бездислокационных гранях монокристаллов Ag, полученных электролизом в капиллярах. При повышении
связанного с возникновением новой пов-сти - ступени роста и, соотв., избыточной краевой энергии. Распространение растущего слоя по пов-сти грани происходит тангенциально, путем присоединения атомов к местам роста (изломам на ступени). Такая электрокристаллизация наблюдается на бездислокационных гранях монокристаллов Ag, полученных электролизом в капиллярах. При повышении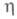 по грани распространяются многослойные "пакеты роста".
по грани распространяются многослойные "пакеты роста". На гранях, имеющих выходы винтовых дислокаций и вследствие этого неисчезающую ступень, распространение слоев при электрокристаллизации происходит в виде спирали, путем присоединения атомов к ступени роста. Грань (или ее часть) принимает форму пирамиды. Чем выше
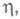 тем меньше угол при вершине пирамиды. Подобная электрокристаллизация по дислокационному механизму не требует затраты энергии на образование двумерных критич. зародышей.
тем меньше угол при вершине пирамиды. Подобная электрокристаллизация по дислокационному механизму не требует затраты энергии на образование двумерных критич. зародышей. При высоких
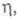 равных 5-10 kT (150-300 мВ), становится возможным "нормальный" рост кристаллов, т. е. прямое присоединение атомов к пов-сти растущей грани в любой ее точке. Грани становятся шероховатыми, теряются такие св-ва кристалла, как устойчивость роста грани и анизотропия скоростей роста по разл. кристаллографич. направлениям. В результате кристаллы приобретают округлую форму.
равных 5-10 kT (150-300 мВ), становится возможным "нормальный" рост кристаллов, т. е. прямое присоединение атомов к пов-сти растущей грани в любой ее точке. Грани становятся шероховатыми, теряются такие св-ва кристалла, как устойчивость роста грани и анизотропия скоростей роста по разл. кристаллографич. направлениям. В результате кристаллы приобретают округлую форму. Кинетика электрокристаллизации. Фазовый переход ион в р-ре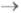 атом в кристаллич. решетке металла протекает через ряд стадий: разряд иона с образованием адатомов, их поверхностная диффузия к месту роста и встраивание в кристаллич. решетку. Каждая из стадий может определять скорость процесса. При низких перенапряжениях (< 30 мВ) для Сu и Ag скорость процесса определяется поверхностной диффузией, при более высоких перенапряжениях - стадией переноса заряда. Адатомы могут нести нек-рый электрич. заряд вследствие частичного разряда ионов. Вероятность разряда иона непосредственно в месте роста или на пов-сти грани с последующей диффузией адатомов к месту роста зависит от концентрации ионов в р-ре, энергии их десольватации и энергии связи атомов в кристаллич. решетке. Предполагается, что преимущественный разряд ионов в месте роста может происходить при энергии сублинации (характеризующей энергию связи атомов в решетке) более 300 Дж/моль.
атом в кристаллич. решетке металла протекает через ряд стадий: разряд иона с образованием адатомов, их поверхностная диффузия к месту роста и встраивание в кристаллич. решетку. Каждая из стадий может определять скорость процесса. При низких перенапряжениях (< 30 мВ) для Сu и Ag скорость процесса определяется поверхностной диффузией, при более высоких перенапряжениях - стадией переноса заряда. Адатомы могут нести нек-рый электрич. заряд вследствие частичного разряда ионов. Вероятность разряда иона непосредственно в месте роста или на пов-сти грани с последующей диффузией адатомов к месту роста зависит от концентрации ионов в р-ре, энергии их десольватации и энергии связи атомов в кристаллич. решетке. Предполагается, что преимущественный разряд ионов в месте роста может происходить при энергии сублинации (характеризующей энергию связи атомов в решетке) более 300 Дж/моль.
Формы роста кристаллов определяются относит. пересыщением р-ра, к-рое в условиях электрокристаллизации соответствует величине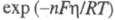 — 1(R - газовая постоянная), а также концентрацией разряжающихся ионов, условиями массопереноса, адсорбцией примесей. При малых плотностях тока через электрохим. ячейку и, соотв., низких перенапряжениях
— 1(R - газовая постоянная), а также концентрацией разряжающихся ионов, условиями массопереноса, адсорбцией примесей. При малых плотностях тока через электрохим. ячейку и, соотв., низких перенапряжениях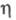 наблюдается рост единичных кристаллов, в частности нитевидных. Кол-во металла, выделяющегося на единице площади пов-сти растущих граней при электролизе, сохраняется постоянным при разл. величинах силы тока и, соотв., общая площадь растущих граней подстраивается к заданной плотности тока. Быстро растущие грани кристаллов вырождаются в процессе роста, кристалл оказывается оформленным медленно растущими гранями. В отсутствие примесей кристаллы с гранецентрир. или объемноцентрир. кубич. решетками обычно оформлены гранями (111), (100), (110).
наблюдается рост единичных кристаллов, в частности нитевидных. Кол-во металла, выделяющегося на единице площади пов-сти растущих граней при электролизе, сохраняется постоянным при разл. величинах силы тока и, соотв., общая площадь растущих граней подстраивается к заданной плотности тока. Быстро растущие грани кристаллов вырождаются в процессе роста, кристалл оказывается оформленным медленно растущими гранями. В отсутствие примесей кристаллы с гранецентрир. или объемноцентрир. кубич. решетками обычно оформлены гранями (111), (100), (110).
При малых концентрациях ионов в р-ре массоперенос к растущей пов-сти играет главенствующую роль в определении морфологии роста кристаллов при электрокристаллизации. Высокие плотности тока обеспечивают перенапряжение, достаточное для роста боковых граней нитевидного кристалла, на катоде возникают дендриты. Адсорбция и соосаждение примесей тормозят линейный рост кристаллов, вызывают искажение кристаллич. решетки и понижают устойчивость фронта роста граней, способствуют образованию на электроде соматоидных структур. При больших концентрациях соосаждающихся примесей (Р, В, S и др.) кристаллич. решетка оказывается предельно нарушенной, возникают системы аморфного строения - металлич. стекла.
Электрокристаллизация- уникальный метод для изучения механизма зарождения и роста кристаллов, т. к. позволяет изменять пересыщение в широких интервалах и по любой программе. Электрокристаллизация - основа многих электрохим. технологий, в т. ч. электролиза, гальванотехники. Осаждение металлов из разбавленных р-ров в условиях роста дендритов используют для получения порошков Сu, Ni, Fe и др. (см. также Электроосаждение).
Лит.: Горбунова К.М., Данков П.Д., "Успехи химии", 1948, т. 17, с. 710-32; Феттер К., Электрохимическая кинетика, пер. с нем., М., 1967; Каишев Р., Избранные труды, София, 1980; Данилов А.И., Полукаров Ю.М., "Успехи химии", 1987, т. 56, в. 7, с. 1082-1104.
Ю. М. Полукаров.
