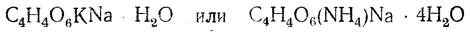D-Винная кислота
D-Винная кислота, или обыкновенная винная кислота, называемая в медицине виннокаменной кислотой (acidum tartaricum), была известна в виде кислой калиевой соли («винного камня») еще в древности.
Свободная D-винная кислота была получена Шееле (1769). Она очень распространена з растениях, например в тамариндах, в рябине, особенно в соке винограда. При брожении виноградного сока она выпадает в виде винного камня, содержащего много кислого виннокислого калия с примесью небольших количеств виннокислого кальция. Свободная кислота получается путём обработки винного камня минеральными кислотами и очищается перекристаллизацией.
D-Винная кислота кристаллизуется в больших прозрачных моноклинных призмах (т. пл. 170° С), легко растворяется в воде и спирте, нерастворима в эфире. Как и в случае яблочной кислоты, удельное вращение винной кислоты в водных растворах изменяется в зависимости от концентрации. С повышением концентрации правое вращение винной кислоты уменьшается.
При нагревании D-винной кислоты выше температуры плавления она теряет воду, превращаясь в различные ангидриды. При более сильном нагревании она частью обугливается, частью дает перегоняющиеся продукты; в наибольшем количестве образуются пировиноградная кислота СН3—СО—СООН и метилянтарная (пировинная) кислота. При этерификации винной кислоты получаются кислые и средние ее эфиры.
Как диоксиянтарная кислота, D-винная кислота дает при восстановлении иодистым водородом сначала D-яблочную, а затем янтарную кислоту. При действии хлористого ацетила получается диацетилвинная кислота
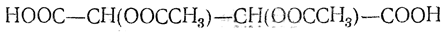
Винная кислота восстанавливает аммиачную окись серебра и может поэтому использоваться для серебрения. При нагревании некоторых солей винной кислоты, а также при осторожном окислении винной кислоты легко получается глиоксаль СНО—СНО. При осторожном действии концентрированной азотной кислоты получается так называемая нитровинная кислота
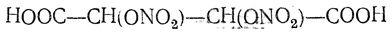
легко превращающаяся в диоксивинную кислоту
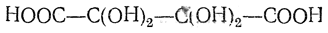
гидратную форму дикетоянтарной кислоты. Диоксивинная кислота плавится при 114—115° С, отщепляя CO2 и Н2О; при этом образуется тартроновая кислота.
Из солей винной кислоты (тартратов) замечательна по нерастворимости в воде кислая калиевая соль С4Н5О6К, применяемая поэтому в аналитической химии для открытия иона калия. Еще менее растворима средняя кальциевая соль. Двойная соль антимонила и калия (рвотный камень)
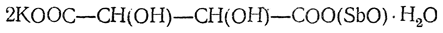
легко растворима в воде. Она получается кипячением кислого тартрата калия с окисью сурьмы и водой.
В присутствии солей винной кислоты щелочи не осаждают гидроокисей некоторых тяжелых металлов. Так, если к смеси растворов медного купороса и тартрата щелочного металла прибавить едкого кали, то получается прозрачный, интенсивно синий раствор, так называемая фелингова жидкость.
При этом в щелочных растворах получаются соединения, содержащие комплексный ион, в котором медь находится во внутренней сфере в неионизированном состоянии, например:
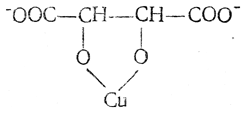
Поэтому щелочи и не осаждают гидроокиси меди в присутствии винной кислоты
Фелингова жидкость часто применяется как реактив на восстановительную способность веществ. Так, она восстанавливается альдегидами, простейшими сахарами и т. п., причем на холоду выделяется оранжево-желтый осадок гидроокиси закисной меди, а при нагревании — красный осадок безводной закиси меди.
Винная кислота образует весьма хорошо кристаллизующиеся двойные соли щелочных металлов — сегнетовы соли, например