Обмен серосодержащих аминокислот
В молекулах белка обнаружены три серосодержащие аминокислоты (ме-тионин, цистеин и цистин), метаболически тесно связанные друг с другом. Благодаря наличию в составе цистеина высокореактивной SH-группы в тканях легко осуществляется ферментативная окислительно-восстановительная реакция между цистеином и цистином.
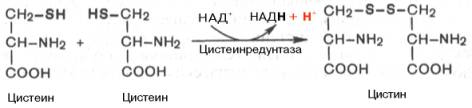
Дисульфидная связь часто образуется между двумя остатками цистеина внутри одной полипептидной цепи или между двумя полипептидными цепями, способствуя тем самым стабилизации молекулы белка. Цистеин является составной частью трипептида глутатиона, сокращенно обозначаемого Г—SH, что подчеркивает функциональную значимость его тио-группы и возможность образования дисульфидной связи окисленного глу-татиона (Г—S—S—Г).
Известно, что многие ферменты содержат в активном центре SH-груп-пы, абсолютно необходимые для каталитической реакции. При их окислении ферменты теряют свою активность. Предполагают, что одной из главных функций глутатиона является сохранение этих ферментов в активной восстановленной форме. Окисленный глутатион может восстанавливаться под действием глутатионредуктазы, используя НАДФН. Кроме того, глутатион может оказывать ингибирующее действие на некоторые белки. В частности, известная реакция инактивации инсулина под действием глутатионинсулинтрансгидрогеназы, в которой SH-глутатион является донором водородных атомов, разрывающих дисульфидные связи между двумя полипептидными цепями молекулы инсулина. Установлена также коферментная функция глутатиона, в частности для глиоксилазы I. Ранее обсуждалось участие глутатиона в транспорте аминокислот через клеточную мембрану.
В процессе катаболизма сера метионина в тканях в основном переходит в серу цистеина, а взаимопревращение цистина в цистеин осуществляется легко. Поэтому проблема окисления серы всех аминокислот практически сводится к окислению цистеина. Главным путем оказался окислительный, включающий окисление цистеина в цистеинсульфиновую кислоту, транс-аминирование последней с α-кетоглутаратом и образование пирувата и сульфита по схеме:
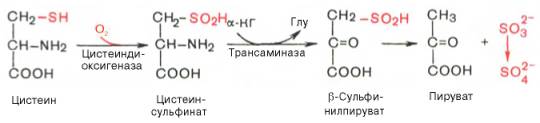
Сульфит затем быстро окисляется в тканях и выводится с мочой в виде нетоксичных сульфатов и эфиросерных кислот. Использование цистеина и продуктов его окисления – цистеинсульфиновой и цистеиновой кислот – в образовании таурина рассмотрено ранее.
Метаболические пути превращения метионина в тканях значительно разнообразнее, чем пути превращения других серосодержащих аминокислот; тем не менее катаболизм метионина осуществляется через цистеин. Это превращение метионина в цистеин оказалось необратимым процессом. Выяснилось также, что углеродный скелет цистеина происходит из другой аминокислоты, а именно серина. Фактическим донором метильных групп в реакциях трансметилирования является не свободный метионин, а так называемый активный метионин – S-аденозилметионин, который образуется в процессе АТФ-зависимой реакции, катализируемой метионин-аденозилтрансферазой.
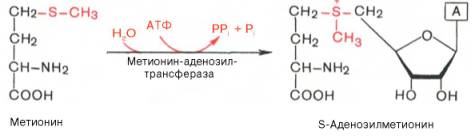
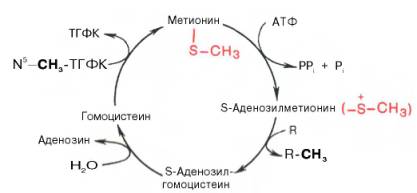
Своеобразие данной реакции заключается в том, что СН3-группа ме-тионина активируется под действием положительного заряда соседнего атома серы. S-аденозилметионин участвует во всех реакциях, где метильная группа используется в биосинтетических реакциях: например, в синтезе адреналина, креатинина, тимина, фосфатидилхолина, бетаина и др. Образовавшийся после отщепления метильной группы S-аденозилгомоцистеин подвергается гидролизу на аденозин и гомоцистеин; последний используется в синтезе серина (это основной путь превращения) или служит акцептором метильной группы от N5—СН3—ТГФК в синтезе метионина (эту реакцию катализирует гомоцистеинметилтрансфераза), завершая, таким образом, своеобразный цикл активирования метильной группы.
В качестве примера приводим схему биосинтеза креатина, в котором принимают участие три аминокислоты: аргинин, глицин и метионин. Реакция синтеза протекает в две стадии. Первая стадия – биосинтез гуанидинацетата – осуществляется в почках при участии глицин-амидинотранс-феразы (КФ 2.1.4.1):
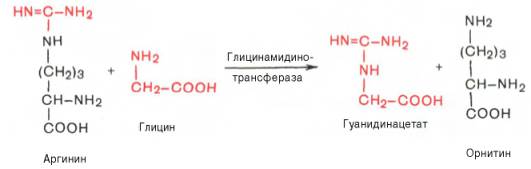
Вторая стадия синтеза креатина протекает в печени при участии гуанидинацетатметилтрансферазы (КФ 2.1.1.2):
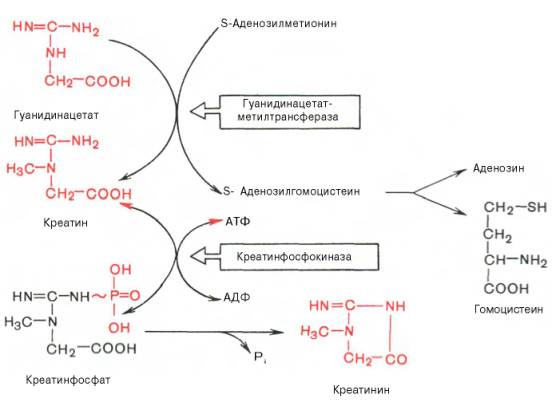
Креатин подвергается фосфорилированию с образованием креатин-фосфата, который после дефосфорилирования (необратимая реакция) превращается в креатинин, выделяющийся с мочой.
Гомоцистеин может вновь превращаться в метионин путем метилирования. Однако основной путь дальнейшего превращения гомоцистеина связан с его использованием в синтезе цистеина, который может быть представлен в виде двух последовательных ферментативных реакций.
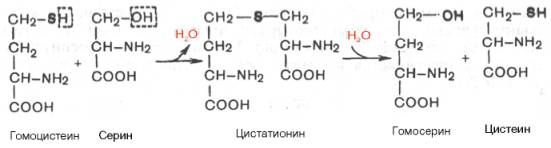
Ферменты, катализирующие синтез и распад цистатионина (циста-тионин-β-синтаза и цистатионаза), содержат ПФ. Цистеин далее подвергается окислению по описанному ранее пути, а гомосерин после транс-аминирования с α-кетоглутаратом превращается в α-кетомасляную кислоту; последняя может также образоваться из цистатионина непосредственно, минуя стадию гомосерина.


