Растворы (химич.)
Растворы, макроскопически однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы. В растворах все компоненты находятся в молекулярно-дисперсном состоянии; они равномерно распределены в виде отдельных атомов, молекул, ионов или в виде групп из сравнительно небольшого числа этих частиц. С термодинамической точки зрения растворы — фазы переменного состава, в которых при данных внешних условиях соотношение компонентов может непрерывно меняться в некоторых пределах. Растворы могут быть газообразными, твёрдыми (см. Твёрдые растворы). Чаще же всего термин «растворы» относят к жидким растворам.
Практически все жидкости, встречающиеся в природе, представляют собой растворы: морская вода — раствор большого числа неорганических и органических веществ в воде, нефть — раствор многих, как правило органических, компонентов и т.д. Растворы широко представлены в технике и повседневной практике человека.
Простейшие составные части растворов (компоненты) обычно могут быть выделены в чистом виде; их смешением можно вновь получить растворы любого допустимого состава. Количественное соотношение компонентов определяется их концентрациями. Обычно основной компонент называют растворителем, а остальные компоненты — растворенными веществами. Если одним из компонентов является жидкость, а другим — газы или твёрдые вещества, то растворителем считают жидкость.
Классификация растворов основана на различных признаках. Так, в зависимости от концентрации растворённого вещества растворы делят на концентрированные и разбавленные; в зависимости от характера растворителя — на водные и неводные (спиртовые, аммиачные и т.п.); в зависимости от концентрации ионов водорода — на кислые, нейтральные и щелочные.
В соответствии с термодинамическими свойствами растворы подразделяют на те или иные классы, прежде всего — на идеальные и неидеальные (называемые также реальными). Идеальными растворами называют такие растворы, для которых химический потенциал mi каждого компонента i имеет простую логарифмическую зависимость от его концентрации (например, от мольной доли xi):
mi = 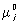 (p, T) + RT lnxi, (1)
(p, T) + RT lnxi, (1)
где через обозначен химический потенциал чистого компонента, зависящий только от давления р и температуры Т, и где R — газовая постоянная. Для идеальных растворов энтальпия смешения компонентов равна нулю, энтропия смешения выражается той же формулой, что и для идеальных газов, а изменение объёма при смешении компонентов равно нулю. Эти три свойства идеального раствора полностью характеризуют его и могут быть взяты в качестве определяющих для идеального раствора. Для идеальных растворов выполняются Рауля законы и Генри закон. Опыт показывает, что раствор идеален только в том случае, если образующие его компоненты сходны друг с другом прежде всего в отношении геометрической конфигурации и размера молекул. Наиболее близки к идеальным растворам смеси соединений с изотопозамещёнными молекулами.
Как правило, для идеальных растворов соотношение (1) справедливо во всей области изменения концентраций. Концентрации, при которых в данном растворе начинают обнаруживаться заметные отклонения от идеальности, очень сильно зависят от природы образующих его веществ. Большинство достаточно разбавленных растворов ведут себя как идеальные.
Растворы, не обладающие свойствами идеальных растворов, называются неидеальными. Для них выполняется соотношение, аналогичное (1) при замене концентрации на активность: ai = gixi, где ai — активность компонента i, gi — коэффициент активности, зависящий как от концентрации данного компонента, так и от концентраций остальных компонентов, а также от давления и температуры. Среди неидеальных растворов большой класс составляют регулярные растворы, которые характеризуются той же энтропией смешения, что и идеальные растворы, однако их энтальпия смешения отлична от нуля и пропорциональна логарифмам коэффициентов активности. Особый класс составляют атермальные растворы, у которых теплота смешения равна нулю, а коэффициенты активности определяются только энтропийным членом и не зависят от температуры. Теория таких растворов часто позволяет предсказывать свойства неидеальных растворов, например в случае неполярных компонентов с сильно различающимися молекулярными объёмами. Близки к атермальным многие растворы высокомолекулярных соединений в обычных растворителях.
При определённых температуре и давлении растворение одного компонента в другом обычно происходит в некоторых пределах изменения концентраций. Раствор, находящийся в равновесии с одним из чистых компонентов, называется насыщенным (см. Насыщенный раствор), а его концентрация — растворимостью этого компонента. Графически зависимость растворимости от температуры и давления представляется растворимости диаграммой. При концентрациях растворённого вещества, меньших его растворимости, раствор является ненасыщенным. Если раствор не содержит центров кристаллизации, то его можно переохладить так, что концентрация растворённого вещества окажется выше его растворимости, а раствор становится пересыщенным. Ряд практически важных свойств растворов связан с изменением давления насыщенного пара растворителя над раствором при изменении концентрации растворённого вещества: понижение температуры замерзания (см. Криоскопия), повышение температуры кипения (см. Эбулиоскопия) и т.д.
Строение раствора определяется прежде всего характером компонентов, его образующих. Если компоненты близки по химическому строению, размерам молекул и т.п., то строение раствора принципиально не отличается от строения чистых жидкостей. Молекулы веществ, заметно отличающихся по своему строению и свойствам, обычно сильнее взаимодействуют друг с другом, что приводит к образованию комплексов в растворах, которые вызывают отклонения от идеальности. Энергии образования этих комплексов достигают величин нескольких кдж/моль, что позволяет говорить о существовании в растворах слабых химических взаимодействий и образовании тех или иных химических соединений — новых компонентов растворов. Взаимодействие с молекулами растворителя сопровождается у многих веществ (например, электролитов) обратным процессом — диссоциацией. Соли, кислоты и основания при растворении в воде и др. полярных растворителях частично или полностью распадаются на ионы, вследствие чего число различных частиц в растворе увеличивается. При электролитической диссоциации суммарная электронейтральность раствора сохраняется; около каждого иона образуется слой более тесно связанных с ним молекул растворителя — сольватная оболочка (см. Сольватация). В растворе при очень малых концентрациях растворённого вещества сохраняется структура растворителя. По мере увеличения концентрации возникают новые структуры, например в водных растворах возникают различные структуры кристаллогидратов. Ионы больших размеров разрушают структуру растворителя, в результате чего появляются экспериментально наблюдаемые неоднородности в этой структуре. Специфическими особенностями характеризуются растворы высокомолекулярных соединений (см. Растворы полимеров). Молекулярно-статистическая теория растворов развита лишь для простейших классов растворов. Так, при рассмотрении растворов неассоциированных жидкостей часто используют представление о растворах как о статистической совокупности твёрдых образований («сфер», «эллипсоидов», «стержней»), взаимодействующих друг с другом по определённому модельному закону. Для сильно разбавленных растворов электролитов ограничиваются учётом только электростатического взаимодействия ионов как точечных зарядов или как сферических образований определённого радиуса и т.д.
Лит.: Кириллин В. А., Шейндлин А. Е., Термодинамика растворов, М., 1956; Шахпаронов М. И., Введение в молекулярную теорию растворов, М., 1956; Prigogine I., The molecular theory of solutions, Arnst., 1957; Робинсон Р., Стокс Р., Растворы электролитов, пер. в англ., М., 1963; Тагер А. А., Физико-химия полимеров, 2 изд., М., 1968; Курс физической химии, под общ. ред. Я. И. Герасимова, 2 изд., т. 1—2, М., 1969—73.
Н. Ф. Степанов.
