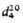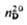Органосилазаны
ОРГАНОСИЛАЗАНЫ (силазаны), кремнийорг. соединения со связями Si—N. Наиб. обширна группа моноциклических органосилазанов общей ф-лы (RR'SiNR'' (n = 2-4). Известны также полиэдрические органосилазаны, напр. общей ф-лы [RSi(NR:)1,5]n (R, R', R: = алкил, арил, алкенил, п = 4 или 6).
Органосилазаны-бесцв. или окрашенные жидкости, масла или кристал-лич. в-ва (см. табл.), нек-рые из них-с резким раздражающим запахом. Олигомерные и полимерные органосилазаны-в-ва от вазе-линоподобных паст до твердых неплавящихся порошков. Большинство органосилазанов раств. в инертных орг. р-рителях. Для поли-органосилазанов с метильными, метилвинильными или метилфе-нильными группами у атомов Si характерны высокие термо-и влагостойкость, адгезия к стали от 20 до 75 кг/см2, tg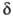 = 0,0006-0,0031,
= 0,0006-0,0031, 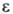 = 3,0-3,6 (20 °С, 106 Гц). Органоцик-лодисилазаны - одни из наиб. термостабильных кремнийорг. соединений. Линейные и циклические органосилазаны образуют комплексы с BF3, Al(C2H5)3, TiCl4; органосилазаны, металлированные по атому N,-c диоксаном, диэтиловым эфиром, ТГФ, пиридином.
= 3,0-3,6 (20 °С, 106 Гц). Органоцик-лодисилазаны - одни из наиб. термостабильных кремнийорг. соединений. Линейные и циклические органосилазаны образуют комплексы с BF3, Al(C2H5)3, TiCl4; органосилазаны, металлированные по атому N,-c диоксаном, диэтиловым эфиром, ТГФ, пиридином.
На воздухе органосилазаны гидролизуются. Стойкость органосилазанов к гидролизу обратно пропорциональна их основности; электроно-акцепторные заместители у атома азота снижают основность вплоть до полного исчезновения основных св-в, напр, у [(CH3)3Si]3N. При гидролизе органосилазанов с фрагментами
 образуются силоксановые связи (~ на 85%).
образуются силоксановые связи (~ на 85%).
В кислых средах скорость гидролиза увеличивается.
Органосилазаны реагируют со спиртами, фенолами, к-тами и сила-нолами с расщеплением силазановой связи и образованием соответствующих алкокси-, арокси- и гидроксипроизводных и силоксановых группировок, напр.:
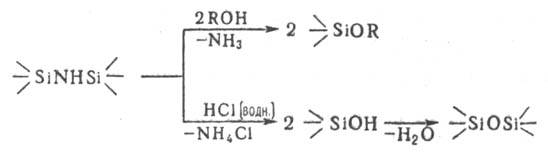
При действии НСl цикло-органосилазаны расщепляются до диоргано-дихлорсиланов и аммониевых солей. Переаминирование органосилазанов в зависимости от условий р-ции приводит либо к диоргано-ди(органоамино)силанам, либо к новым N-замещенным циклич. соединениям:
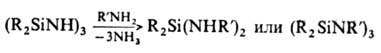
При действии изоцианатов (или изотиоцианатов) на органосилазаны образуются силилзамещенные мочевины.
Щелочные металлы (напр., в жидком NH3), их амиды, LiAlH4, орг. соед. Li и др. металлируют органосилазаны по атому N:
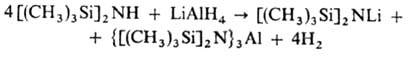
Органосилазаны, содержащие металлы подгруппы Zn, образуются р-цией обменного разложения в эфире:
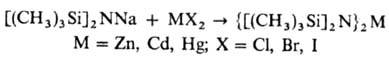
В пром-сти линейные, циклич. и поли-органосилазаны получают аммо-нолизом или аминолизом моно-, ди- и трихлорорганосила-нов, напр.:
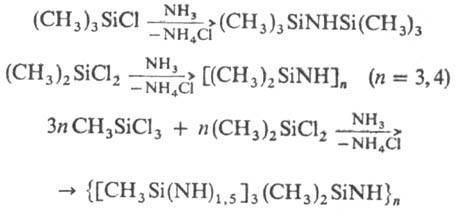
Органосилазаны получают также гомоконденсацией аминосиланов:
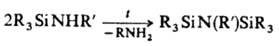
Для синтеза органоциклодисилазанов используют р-ции обменного разложения, а для синтеза N-органилпроиз-водных органосилазанов-пиролиз диаминодиорганосиланов при 200-450 °С:
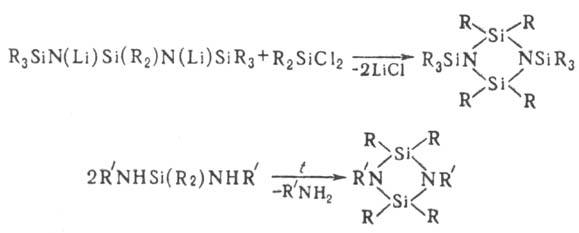
Поли-органосилазаны могут быть получены каталитич. поликонденсацией цикло-органосилазанов в присут. гидроксидов металлов, NH4Br и др.
Применяют органосилазаны в произ-ве пластмасс (связующие и пропиточные составы), в качестве модификаторов резины для повышения диэлектрич. характеристик, адгезивов, отверди-телей эпоксидных смол, гидрофобизаторов кожи, шерсти, тканей, металлов; гексаметилдисилазан применяют для синтеза лек. препаратов, для модификации твердых носителей в ГЖХ, для т. наз. силильной защиты в орг. синтезе.
СВОЙСТВА НЕКОТОРЫХ ОРГАНОСИЛАЗАНОВ
| Соединение | Т. кип., °С/мм рт.ст. | | | ||
| Гексаметилдисилазан (CH3)3SiNHSi(CH3)3 | 125 | 0,772 | 1,408 | ||
| Гексаметилциклотрисилазан [(CH3)2SiNH]3 | 138/456 | 0,919 | 1,444 | ||
| Октаметилциклотетрасилазан [(CH3)2SiNH]4 | 190/10 | 0,952 | 1,476 | ||
| Додекаметилциклотетрасилазан [(CH,)2SiNCH3]4 | 88/2 | 0,977 | 1,481 | ||
| N-Хлоргексаметилдисилазан [(CH3)3Si]2NCl | 56/16 | _ | _ | ||
| N- Литийгексаметилдисилазан [(CH3)3Si]2NLi | 115/1а | - | — | ||
| N-Натрийгексаметилдисилазан [(CH3)3Si]2NNa | 204/2б | — | - | ||
| N, N-бис-(Триметилсилил)-тетраметилциклодисилазан {(CH3)2SiN[Si(CH3)2]}2 | 85/7в | 0,998 | 1,423г | ||
а Т.пл. 70-71 °С. б Т.пл. 183°С. в 39°С. г При 45СС.
Лит.: Борисов С. Н., Воронков М. Г., Лукевиц Э. Я., Кремнеэле-ментоорганические соединения. Л., 1966; Варежкин Ю. М., Синтез и применение полимеров циклодисилазановой структуры. Обзорная информация НИИТЭХИМ, М., 1977;Хананашвили Л. М., Андрианов К. А., Технология элементоорганических мономеров и полимеров, 2 изд., М., 1983.
В. Н. Емельянов.