Аммония тиоцианат
АММОНИЯ ТИОЦИАНАТ (роданид аммония) NH4NCS, бесцв. гигроскопичные кристаллы. До 92 °С устойчива модификация с моноклинной решеткой, выше 92°С - с ромбической. Т. пл. 149,6°С, выше 140°С частично превращ. в (NH2)2CS, выше 170°С разлагается; плотн. 1,3057 г/см3;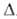 Нообр - 82,0 кДж/моль. Раств. в воде (54,9% при 0°С, 61,9% при 20°С) с большим поглощением тепла, в жидком NH3, спирте и ацетоне; при — 25,2 °С образует гидрат NH4NCS*5,851H2O, в атмосфере NH3 - аммиакаты NH4NCS*nNH3 (n= 1-8). Получают аммония тиоцианат взаимод. NH3 с CS2 и при улавливании цианистых соед., содержащихся в коксовом газе, р-рами полисульфида аммония с послед. выделением и очисткой. Аммония тиоцианат-реагент для аппретирования и печатания тканей, разделения Zr и Hf, травления железа и стали; компонент электролитов в гальванопластике, проявителей в фотографии, охлаждающих р-ров; реактив для роданометрич. и меркуриметрич. анализов галогенов и цианидов, гравиметрич. определения Cu2+, Zn2+ и Cd2+, фотоколориметрич. определения Fe, Co, Мо и др. Его используют также для получения др. тиоцианатов. Комплексные соед., образуемые аммония тиоцианатом, напр. соль Рейнеке NH4[Cr(NH3)2(NCS)4]*H2O, используют для качеств. определения ряда катионов элементов I-III и VIII групп.
Нообр - 82,0 кДж/моль. Раств. в воде (54,9% при 0°С, 61,9% при 20°С) с большим поглощением тепла, в жидком NH3, спирте и ацетоне; при — 25,2 °С образует гидрат NH4NCS*5,851H2O, в атмосфере NH3 - аммиакаты NH4NCS*nNH3 (n= 1-8). Получают аммония тиоцианат взаимод. NH3 с CS2 и при улавливании цианистых соед., содержащихся в коксовом газе, р-рами полисульфида аммония с послед. выделением и очисткой. Аммония тиоцианат-реагент для аппретирования и печатания тканей, разделения Zr и Hf, травления железа и стали; компонент электролитов в гальванопластике, проявителей в фотографии, охлаждающих р-ров; реактив для роданометрич. и меркуриметрич. анализов галогенов и цианидов, гравиметрич. определения Cu2+, Zn2+ и Cd2+, фотоколориметрич. определения Fe, Co, Мо и др. Его используют также для получения др. тиоцианатов. Комплексные соед., образуемые аммония тиоцианатом, напр. соль Рейнеке NH4[Cr(NH3)2(NCS)4]*H2O, используют для качеств. определения ряда катионов элементов I-III и VIII групп.
Аммония тиоцианат слабо токсичен. ЛД50 720 мг/кг (мыши, перорально). У человека раздражает кожу, вызывает ксантопсию (видение предметов в желтом цвете); при длит. воздействии угнетает щитовидную железу, поражает почки. Р-ры аммония тиоцианата корродируют Си, Fe и нек-рые хромоникелевые сплавы; практически не действуют на А1.
Литература
Химия псевдогалогенидов, пер. с нем. К., 1981. С.К. Смирнов.
