§ 4. Подгруппа брома
Из относящихся к этой подгруппе элементов № 85 – астат (At) –в земной коре отсутствует и был получен искусственно. Так как исследованию подвергались лишь ничтожные его количества, свойства этого элемента почти не изучены.
Содержание в земной коре брома составляет 3·10–5%, а иода 4·10–6%. По характеру распределения в природе оба элемента похожи на хлор, но образование скоплений для них не характерно.
Основными источниками промышленного получения брома являются воды некоторых соляных озер (0,01–0,5% Br) и морская вода (в среднем 0,007% Вr). Частично он добывается также из бромистых соединений, незначительные примеси которых обычно содержатся в природных месторождениях калийных солей, и из буровых вод нефтеносных районов (0,01–0,1% Вr).
Для промышленной добычи иода основное значение имеют именно буровые воды, содержащие в среднем 0,003% J. Другим источником этого элемента являются морские водоросли, зола которых содержит обычно до 0,5% J.
При получении свободных брома и иода чаще всего пользуются вытеснением их хлором по реакциям, например:
MgBr2 + Сl2 = MgCl2 + Вr2
2KJ + Сl2 = 2КСl + J2
Бром выделяется при этом в виде тяжелой буро–краснойжидкости, иод – в твердом состоянии. Ежегодная мировая добыча брома оценивается десятками тысяч тонн, иода – тысячами тонн.
По основным физическим свойствам бром и иод закономерно укладываются в один ряд с хлором и фтором, как это видно из приводимой ниже таблицы (в которую включен также водород).

Довольно закономерно изменяется и устойчивость молекул рассматриваемых элементов – энергии их диссоциации, в общем (за исключением фтора), тем выше, чем меньше расстояние между ядрами:

Плотность брома равна 3,1, иода – 4,9. Так как давление пара твердого иода очень велико, он при нагревании обычно возгоняется. Возгонкой технического иода пользуются для его очистки.
Пары брома и иода обладают резким запахом. По действию на организм бром очень близок к хлору. Он находит наибольшее применение для выработки специальных добавок, повышающих качество моторных бензинов. В виде 5%–ного спиртового раствора (йодной настойки) иод применяется для стерилизации ран. Соединения обоих тяжелых галоидов широко применяются в фотографии, медицине и т. д.
Растворимость брома в воде составляет около 35 г, а иода–0,3 г на литр.. Оба эти галоида (и астат) гораздо лучше растворяются в различных органических растворителях, чем в воде.
1) При соприкосновении водного раствора галоида с органическим растворителем (не смешивающимся с водой) галоид распределяется между ним и водой в строго определенных отношениях. Если взять, например, бром и сероуглерод (CS2 ), то отношение концентрации брома в сероуглеродной фазе к концентрации его в водной при различных общих количествах растворенного брома остается постоянным (и равным примерно 80). В этом постоянстве отношения концентраций (точнее – отношения активностей) распределяемого между двумя несмешивающимися растворителями вещества заключается так называемый закон распределения. Найденное отношение концентраций (в данном примере 80) называется коэффициентом распределения. Величина его (при постоянной температуре) характерна для данной системы: растворитель А – распределяемое вещество – растворитель Б. Распределение имеет большое техническое значение, так как часто позволяет избирательно извлекать то или иное вещество из раствора смеси многих веществ.
По своей наиболее характерной химической функции бром к иод являются одновалентными металлоидами. Как уже указывалось ранее (§1), химическая активность одновалентного металлоида отчасти определяется величиной его сродства к электрону, т. е. той энергией, которая выделяется при присоединении избыточного электрона к соответствующему нейтральному атому. Очевидно, что для отрыва электрона от отрицательного иона точно такое же количество энергии должно быть затрачено.
Ниже сопоставлены радиусы галоидных ионов Г' и соответствующие величины сродства нейтрального атома к электрону:
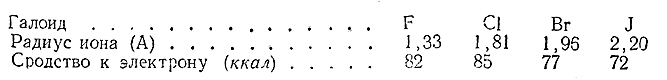
За исключением фтора, наблюдается та закономерность, которую можно было ожидать: чем дальше от ядра находится отрываемый электрон, тем менее прочно он удерживается, т. е. тем меньше сродство к электрону данного нейтрального атома.
В связи с понижением металлоидной активности в ряду F–Cl–Br–J каждый галоид способен вытеснять все стоящие правее него из соединений. О вытеснении хлора фтором уже говорилось ранее (§ 2). Подобным же образом бром вытесняется из своих соединений хлором, а иод–бромом.
И бром и иод являются все же весьма активными металлоидами. Со многими, металлами и некоторыми элементами металлоидного характера (например, фосфором) они способны взаимодействовать при обычных температурах. При этом бром по активности не очень сильно уступает хлору, тогда как иод отличается от него уже значительно.
2) Известные соединения брома, иода и других галоидов друг с другом сопоставлены в приводимой ниже таблице.

Все эти соединения образуются путем непосредственного взаимодействия элементов и являются веществами малоустойчивыми.
Взаимодействие с водородом брома происходит лишь при нагревании, а иода–только при более сильном нагревании и неполностью (так как начинает идти обратная реакция – разложение йодистого водорода). Сами по себе оба галоидоводорода почти не находят применения. Получать их удобно разложением водой соответствующих галоидных соединений фосфора по схеме:
PГ3 + ЗН2 О = Н3 РО3 + ЗНГ
Реакция легко идет уже при обычной температуре.
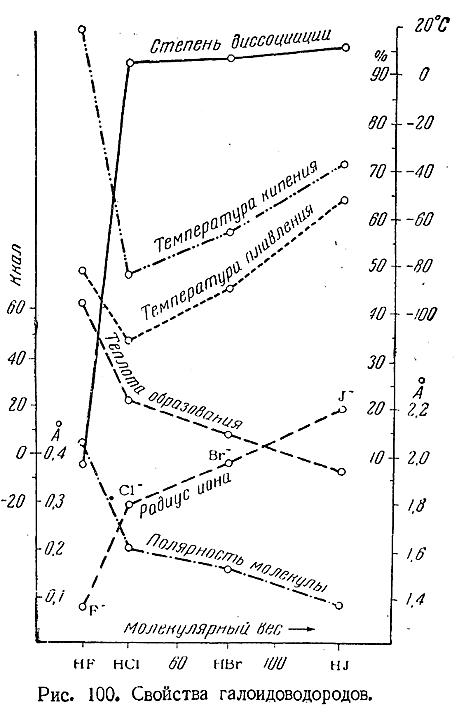
Подобно хлористому водороду, НВr и HJ представляют собой бесцветные газы, дымящие на воздухе и очень хорошо растворимые в воде. Некоторые их свойства сопоставлены со свойствами HF и НСl в приводимой ниже таблице и на рис. 100. В последний включены также радиусы ионов Г–, приблизительно характеризующие размеры молекул соответствующих галоидоводородов.
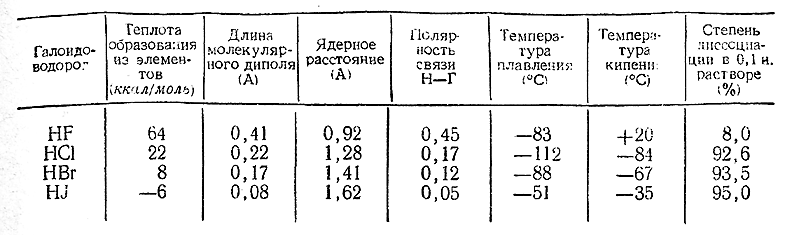
Как видно из рис. 100, в ряду HJ–HBr–HCl свойства изменяются весьма закономерно, тогда как при дальнейшем переходе к HF наблюдается более или менее резкий их скачок, иногда даже в направлении, обратном общему ходу. Обусловлено это сильной ассоциацией фтористого водорода, отсутствующей у его аналогов.
По химическим свойствам НВr и HJ очень похожи на хлористый водород. Подобно последнему, в безводном состоянии они не действуют на большинство металлов, а в водных растворах дают очень сильные бромисто–водородную и иодистово–дородную кислоты. Соли первой носят название бромистых или бромидов, второй – йодистых или иодидов (а производные галоидо–водородных кислот вообще – галоген идов или галидов). Растворимость бромидов и иодидов в большинстве случаев близка к растворимости соответствующих хлоридов. Существование в виде отрицательно одновалентного иона характерно в растворах и для астата.
Существенное различие между HJ, НВr и НСl наблюдается в их отношении к окислителям. Молекулярный кислород постепенно окисляет иодистоводородную кислоту уже при обычной температуре (причем под действием света реакция сильно ускоряется):
О2 + 4HJ = 2Н2 O + 2J2
Бромистоводородная кислота взаимодействует с ним гораздо медленнее, а соляная им вовсе не окисляется. Так как, однако, соляная кислота способна окисляться под действием МnO2 и т. п., из изложенного следует, что галоидоводороды (кроме HF) могут служить в качестве веществ, отнимающих кислород, т. е. в качестве восстановителей, причем наиболее активным является HJ.
Легкая окисляемость в растворах характерна и для производных отрицательно одновалентного астата.
3) Выделяющийся при частичном окислении иодистоводородной кислоты свободный иод не осаждается, а остается растворенным в результате взаимодействия с избытком ионов J’ по схеме:
J’ + J2 <–––> J’3
Образование иона J не сопровождается переходом электронов, а обусловлено притяжением молекулы J2 к иону J’ (так же, как им притягиваются молекулы воды.) Следствием такого образования является хорошая растворимость иода в водных растворах йодистых солей (например, йодистого калия). Некоторые из содержащих ионы J–x соединений – т. н. полииодидов – известны и в твердом состоянии. Примером может служить кристаллогидрат KJ3 ·Н2 О.
Рассмотрение кислородных соединений брома и иода удобно начать с обратимой реакции
Г2 + Н2 О <–––> НГ + НОГ
равновесие которой при переходе от хлора к брому и затем иоду все более смещается влево.
Бромноватистая (НОВr) и иодноватистая (HOJ) кислоты яз–ляются неустойчивыми соединениями и сильными окислителями. В ряду НОСl–НОBr–HOJ и устойчивость и окислительная активность уменьшаются.
В том же направлении ослабляется кислотный характер соединений НОГ. Бромноватистая кислота является уже очень слабой, а иодноватистая обладает амфотерными свойствами. Обе кислоты известны лишь в разбавленных растворах.
4) Перегонку растворов НОВr (К = 2·10–9) можно производить только под сильно уменьшенным давлением, тогда как при получении HOJ ею пользоваться вообще нельзя. Константа диссоциации иодноватистой кислоты по кислотному типу (К = 2·10–11) даже меньше, чем по основному (3·10–10).
Помимо окислительного распада, для НОВr и HOJ характерны реакции по схеме
ЗНОГ = 2НГ + НГО3
ведущие к образованию соответственно бромноватой (НВrО3 ) и йодноватой (HJО3 ) кислот. Из них первая, подобно НСlOз, известна только в растворах, тогда как вторая может быть выделена в виде легкорастворимых кристаллов. Обе кислоты бесцветны.
Бромноватая кислота очень похожа но свойствам на НСlO3 , тогда как и окислительные и кислотные свойства йодноватой выражены значительно слабее. По ряду НСlO3 – HBrO3 – HJO3 растворимость солей уменьшается. Подобно хлоратам, броматы и иодаты в щелочных и нейтральных средах окислителями не являются.
Соответствующий НВrО3 ангидрид неизвестен. При нагревании HJO3 до 230°С образуется порошок йодноватого ангидрида – J2 O5 , который с водой вновь дает йодноватую кислоту. Выше 275 °С он распадается на иод и кислород.
5) Йодноватая кислота образуется, в частности, при действии хлора на взболтанный в воде иод по реакции: J2 +5Cl2 +6H2 O = 2HJO3 + 10HCl. Поэтому при прибавлении к раствору йодистой соли избытка хлорной воды появляющаяся вначале окраска иода затем вновь исчезает. Для получения HJОз обычно пользуются взаимодействием иода с крепкой азотной кислотой, протекающим в основном по уравнению:
J2 +10HNO3 = 2HJO3 + 10NO2 + 4H2 O.
Аналогичные НСlO4 и Cl2 O7 соединения для брома неизвестны. Напротив, хорошо изучена йодная кислота (HJO4 ), а также многие ее соли (периодаты). Последние, как правило, труднорастворимы в воде. Сама кислота может быть получена электролизом раствора HJO3 по схеме:
H2 O + HJO3 = H2 (катод) + HJO4 (анод)
Выделяется она в виде бесцветных кристаллов состава HJO4·2H2 O. Кислотные свойства HJO4 выражены несравненно слабее, чем у НСlО4 , а окислительные, наоборот, гораздо более отчетливо. Отвечающий ей ангидрид неизвестен. При нагревании HJO4 разлагается по уравнению:
2НJO4 –––> Н2 О + J2 O5 + О2
6) Как кислота HJO4 (K = 2·10–2) слабее йодноватой (К = 2 ·10–1). Наоборот, как окислитель она более активна, чем HJO3 (но менее, чем HOJ). В кристаллогидрате HJO4 • 2Н2 О замещаться на металл способны и водороды воды были получены такие соли, как Ag5 JO6 и Ba5 (JO6 )2 . Это показывает, что рассматриваемый кристаллогидрат является в действительности пятиосновной ортоиодной кислотой – H5 JO6 .
Как видно из рассмотренного выше материала, аналогия брома и иода с хлором в их кислородных соединениях выражена уже далеко не столь полно, как в водородных: сходство здесь ограничивается главным образом кислотами типов НОГ и НГО3 их солями. О кислородных соединениях астата известно лишь, что они существуют, причем высшая степень окисления отвечает иону АtOз, т. е. валентности +5.


