§ 4. Коллоиды
Рассмотренная в предыдущем параграфе кремневая кислота является типичным представителем веществ, характеризующихся тенденцией к образованию коллоидных растворов. Поэтому при ее выделении из солей осаждается обычно лишь часть полученного гидрата кремнезема. Соответственно изменяя концентрации растворов, можно подобрать такие условия, при которых осадок совсем не образуется, а вся кремневая кислота остается в коллоидально–растворенном состоянии.
Как уже отмечалось ранее (V § 1), по размерам распределенных частиц коллоидные растворы располагаются между взвесями, с одной стороны, и молекулярными растворами, с другой. Грубо говоря, областью коллоидного состояния вещества можно считать размеры частиц от 1 до 100 ммк. При увеличении в миллион раз молекулы представились бы нам в виде более или менее крупных точек, частицы тонких взвесей приобрели бы размеры большого яблока, а вся промежуточная область величин дала бы различные градации коллоидного дробления вещества.
Дисперсная система с коллоидными размерами распределенных в той или иной среде частиц носит название коллоидного раствора или золя. Наибольшее практическое значение из различных золей имеют гидрозоли, т. е. коллоидные системы, в которых средой является вода.
Подобно молекулам истинного раствора, коллоидные частицы золей находятся в непрерывном беспорядочном движении. Хотя
интенсивность последнего быстро уменьшается по мере увеличения размеров частиц, в случае коллоидных растворов она еще достаточна для того, чтобы противодействовать силе тяжести. Поэтому коллоидные частицы из той среды, в которой они распределены, самопроизвольно не выделяются. Напротив, самопроизвольное выделение под действием силы тяжести характерно для более крупных частиц взвесей, что внешне и отличает последние от коллоидных растворов.
От молекулярных растворов коллоидные обычно можно отличить по их иным оптическим свойствам. Если сквозь стакан с коллоидным раствором пропустить сильный пучок световых лучей, то в результате светорассеяния коллоидными частицами возникает светлый конус, хорошо видимый в темном помещении. Напротив, поставленный в те же условия истинный раствор кажется «оптически пустым», так как содержащиеся в нем частички молекулярных размеров свет заметно не рассеивают. С наличием светорассеяния связана также часто наблюдающаяся опа–лесценция коллоидных растворов, т. е. их мутноватый вид в отраженном свете.
Наряду с оптическими сильно различаются и многие другие свойства коллоидных и молекулярных растворов. Так как коллоидные частицы несравненно больше отдельных молекул, при одинаковой общей концентрации распределенного вещества число их в единице объема гораздо меньше. Вследствие этого изменения свойств растворов, связанные с числом растворенных частиц (осмотические явления, понижение температуры замерзания и т. д.), проявляются у коллоидных растворов лишь в ничтожно малой степени.
Существенной особенностью коллоидного состояния вещества, непосредственно связанной с малыми размерами частиц, является колоссальное развитие их общей поверхности. Если представить себе кубик с длиной ребра в 1 см, то объем его будет равен 1 см3, а общая поверхность составит 6 см2. При дроблении дан ного кубика на более мелкие суммарный объем последних остается тем же, а их общая поверхность, как это видно из данных приводимой таблицы, чрезвычайно быстро увеличивается.
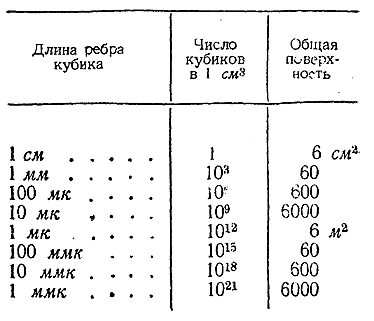
В области размеров коллоидных частиц (100 ммк– 1 ммк) степень дисперсности вещества (т. е. отношение поверхности к объему) огромна. В связи с этим для коллоидов особенно характерны все процессы, протекающие на поверхности раздела двух фаз, в частности, адсорбция.
1) Так как диаметр пор обычной фильтровальной бумаги составляет 10000–З000 ммк, сквозь нее легко проходят частицы не только всех коллоидных растворов, но и тонких взвесей. То же относится и к «уплотненным» фильтрам с порами диаметром до 1000 ммк. Стеклянные фильтры обычно имеют поры диаметром в интервале 100 000–10 000 ммк, специальные фарфоровые и глиняные – до 100 ммк. Последние уже полностью задерживают взвеси, но еще пропускают частицы коллоидных растворов. Частицы эти могут быть задержаны пленками некоторых веществ (например, коллодия), служащими для изготовления так называемых ультрафильтров. Наиболее плотные ультрафильтры имеют поры диаметром до 1 ммк и задерживают уже не только все коллоидные частицы, но и отдельные, особенно объемистые молекулы истинных растворов.
Так как по своим размерам коллоидные частицы лежат между частицами взвесей и молекулами, к получению вещества в коллоидном состоянии можно подойти с двух сторон: либо путем дробления более крупных частиц, либо, наоборот, путем образования агрегатов из отдельных молекул. Методы получения коллоидов по первому пути носят название дисперсионных, по второму – конденсационных. Простейшим по идее дисперсионным методом является механическое дробление исходного вещества. Таким путем при помощи специальных коллоидных мельниц могут быть получены частицы диаметром до 10 ммк.
Еще чаще применяются конденсационные методы, основанные на различных химических реакциях, ведущих к образованию практически нерастворимых в избранной среде веществ. Регулируя условия протекания процесса, можно добиться выделения этих веществ в виде коллоидных частиц тех или иных размеров.
По отношению к жидкой фазе, в которой они распределены, коллоидные частицы распадаются на две большие группы. Представители одной из них адсорбируют на своей поверхности молекулы вещества окружающей среды и образуют с ними более или менее прочные комплексы сольватного типа. Такие коллоиды называют лиофильными (в частном случае воды – гидрофильными). Каждая частица лиофильного коллоида окружена связанной с ней жидкой оболочкой, которая не вполне разрушается даже при слипании частиц друг с другом. Вследствие этого при образовании более крупных агрегатов в их состав включается и жидкая фаза.
Представители другой группы коллоидов не адсорбируют молекул жидкой фазы Подобные коллоиды носят название лиофобных (в частном случае воды–гидрофобных). В их золях отдельные частицы не окружены пленкой жидкой фазы, и последняя при образовании более крупных агрегатов в них не включается. Примером гидрофобного коллоида может служить сернистый мышьяк, примерами гидрофильных – кремневая кислота и окись железа.
Помимо вещества той среды, в которой они распределены, коллоидные частицы способны адсорбировать и другие присутствующие в жидкой фазе молекулы, а также – что особенно важно – ионы. В последнем случае они сами становятся электрически заряженными. Так как свойства поверхности у одинаковых коллоидных частиц одни и те же, все они заряжаются при этом одноименно: адсорбирующие преимущественно катионы – положительно (положительные коллоиды), адсорбирующие главным образом анионы – отрицательно (отрицательные коллоиды). Положительными при обычных условиях получения являются, в частности, гидрозоли окислов металлов, отрицательными – гидрозоли сернистых соединений, (а также кремневой кислоты).
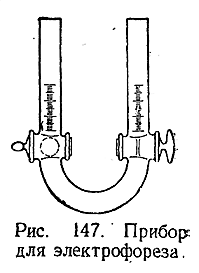
Знак заряда коллоидных частиц может быть установлен на опыте, так как под действием постоянного электрического тока положительные коллоиды передвигаются к катоду, а отрицательные – к аноду. При изучении этого явления (называемого электрофорезом) исследуемый гидрозоль помещают в нижнюю часть снабженной кранами U–образной трубки (рис. 147), затем закрывают оба крана, промывают верхнюю часть прибора, заполняют ее водой и опускают в последнюю электроды. После открывания обоих кранов и включения постоянного тока в трубке начинает происходить электрофорез. Передвижение коллоидных частиц от одного полюса к другому особенно легко наблюдать в случае цветных золей непосредственно по изменению уровней окрашенного слоя жидкости в обоих коленах трубки.
Электрофорез находит ряд технических применений. Например, при производстве фарфора с его помощью освобождают глину от примесей окислов железа. Метод основан на том, что частицы взболтанной в воде глины заряжаются отрицательно, тогда как частицы окиси железа –положительно. При пропускании сквозь взвесь электрического тока у анода собирается очень чистая глина.
Из изложенного выше следует, что в состав коллоидной частицы, кроме непосредственного образующего ее вещества, могут входить также тесно с ней связанные молекулы жидкой фазы и адсорбированные ионы. Кроме того, в окружающей среде около частицы неизбежно должны находиться ионы противоположного знака. Рассматриваемая в совокупности со всеми этими дополнениями коллоидная частица носит название мицеллы, а часть последней, содержащая только непосредственно связанные с коллоидной частицей молекулы и ионы, – гранулы.
Например, в состав полученного гидролизом FeCl3 гидрозоля окиси железа, кроме Fe2 O3 , входят еще вода, адсорбированные коллоидной частицей ионы Fe3+и окружающие ее в жидкой фазе ионы Сl–. Общая формула мицеллы этого гидрозоля имеет вид xFe2 O3 ·yH2 O·zFe3+ + 3zCl–, а формула гранулы – xFe2 O3 ·yH2 O·zFe3+Подобным же образом общая формула мицеллы гидрофобного золя As2 S3 имеет вид xAs2 S3 ·zSH– + zH, a гранулы – a:As2 S3 ·zSH–. Схематически это часто изображают так:
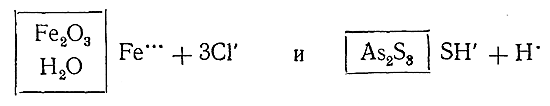
Подобные схематические формулы мицелл и гранул выражают состав тех и других лишь качественно, т. е. указывают их составные части, но не дают представления об относительных количествах этих частей.
Хотя между частицами каждого золя и действует взаимное притяжение по закону всемирного тяготения, но возникающие таким путем силы очень малы. Несравненно большее значение для возможности стяжения частиц друг с другом имеет взаимодействие их поверхностных слоев (ср. рис. 99). Однако заметно сказаться оно может только при столь тесном соприкосновении, которое возникает вследствие столкновения беспорядочно движущихся частиц золя.
В результате проявления сил стяжения наступает коагуляция золя, т. е. слипание его частиц друг с другом и образование из них более сложных агрегатов. Достигнув известной величины, частицы становятся уже неспособными удерживаться во взвешенном состоянии и выделяются из той среды, в которой они были распределены, – происходит седиментация коллоида. Как следует из изложенного, коагуляция представляет собой процесс укрупнения частиц золя, а седиментация – результат этого процесса. Однако термином коагуляции часто охватывают и то и другое вместе.
Важнейшим фактором, противодействующим коагуляции, является наличие на коллоидных частицах электрических зарядов. Вследствие одноименности последних движущимся навстречу друг другу частицам лишь в крайне редких случаях удается сойтись настолько близко, чтобы между ними могли достаточно эффективно проявиться силы стяжения. В результате содержащий сильно заряженные коллоидные частицы золь заметно не коагулирует даже при долгом хранении, т. е. является весьма устойчивым.
Очевидно, что снятие с коллоидных частиц их электрического заряда (хотя бы частичное) должно понижать устойчивость золей и способствовать их коагуляции. Такое разряжение в случае
гидрозолей может быть проще всего достигнуто добавлением к коллоидному раствору электролитов. Хотя при этом вводится одинаковое число положительных и отрицательных зарядов, но в непосредственно окружающей коллоидную частицу «ионной атмосфере» всегда несколько преобладают ионы, противоположна ей заряженные, которые частицей преимущественно и адсорбируются. Так как введение электролита сильно повышает общую концентрацию ионов в растворе, условия для их адсорбции становятся весьма благоприятными и первоначальный заряд частиц быстро нейтрализуется, [следствием чего является коагуляция золя. Природный процесс коагуляции электролитами широко осуществляется в устьях рек, где приносимые последними коллоиды и взвеси осаждаются под действием солей морской воды.
В случае гидрофобных коллоидов коагуляция электролитами обычно происходит легко и для достижения седиментации достаточно уже сравнительно небольших концентраций ионов. Напротив, коагуляция гидрофильных коллоидов, частицы которых покрыты слоем адсорбированных молекул воды, часто идет значительно труднее и их седиментация .иногда наступает лишь при высоких концентрациях электролита.
Осадки коллоидов (коагуляты) имеют различную структуру. Лиофобные коллоиды при седиментации не увлекают с собой жидкую фазу и выпадают в виде тонких порошков или хлопьев. Напротив, лиофильные коллоиды увлекают более или менее значительные количества жидкой фазы, что и обусловливает студенистый характер их осадков. Золи некоторых лиофильных коллоидов (например, желатины) даже нацело застывают в студнеобразную массу (желе, студень). Подобные коагуляты, содержащие в своем составе увлеченную жидкую фазу, называют обычно гелями (для воды в качестве жидкой фазы – гидрогелями).
2) В зависимости от отношения образующихся при седиментации осадков к воде (или соответственно другой жидкой фазе) коллоиды делятся на обратимые и необратимые. Осадки первых при соприкосновении с чистой водой вновь самопроизвольно переходят в нее с образованием золя. Так ведет себя, например, гуммиарабик. Напротив, осадки необратимых коллоидов при простом соприкосновении с жидкой фазой самопроизвольно в нее не переходят. Примерами необратимых коллоидов могут служить кремневая кислота, окись железа, As2 S3 и т.д.
3) Хотя при простом соприкосновении осадков необратимых коллоидов с чистой водой золи и не образуются, однако иногда они могут быть получены, если к воде добавить ничтожное количество электролита. Ионы последнего, адсорбируясь на частицах осадка, заряжают их одноименно, в результате чего частицы отталкиваются друг от друга и распределяются по всему объему жидкой фазы. Процесс образования золя действием очень небольших концентраций электролитов на осадки необратимых коллоидов носит название пептизации. Последняя является одним из важнейших дисперсионных методов получения золей.
Помимо рассматривавшихся выше гидрозолей, все большее практическое значение приобретают дисперсные системы в газообразной среде – образованные частицами твердых веществ (дымы) или капельками жидкостей (туманы). Если средой является воздух, то такие системы называют аэрозолями. Примером аэрозоля может служить табачный дым (средний диаметр частиц 0,25 мк).
В электрическом поле высокого напряжения частицы аэрозолей подвергаются электрофорезу, причем, достигнув электродов, они теряют свой заряд и осаждаются. Электрофорез аэрозолей находит ряд важнейших практических применений для очистки газов от взвешенных в них твердых и жидких частиц. В одних случаях такая очистка бывает необходима для возможности проведения производственных процессов (например, очистка SO2 при контактном получении H2 SO4 ), в других – при ее помощи улавливают различные уносимые отходящими газами з в виде пыли ценные продукты. Наконец, электрофорез аэрозолей очень важен с санитарно–гигиенической точки зрения, так как позволяет очищать выпускаемые на воздух газы от вредных отходов производства.
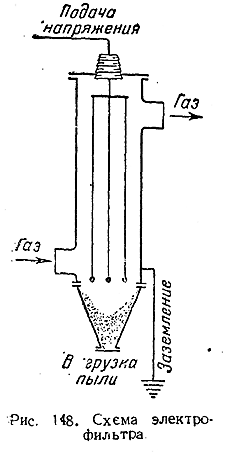
4) Схема «электрофильтра», приспособленного для обеспыливания отходящих газов, показана на рис. 148. Его основной рабочей частью является металлическим цилиндр, по оси которого проходят изолированные от стенок и натягиваемые грузами проволоки. Последние сообщаются с отрицательным полюсом источника постоянного тока, причем между проволоками и заземленными стенками цилиндра создается разность потенциалов порядка 100 тысяч вольт. При этих условиях с проволок все время срывается поток электронов, сообщающих взвешенным в газе пылинкам отрицательный заряд Зарядившиеся частицы быстро движутся к стенкам цилиндра и отдают им свой заряд, после чего падают в нижнюю камеру аппарата, откуда пыль затем периодически выгружается. Кроме подобных описанному выше трубчатых электрофильтров, применяются и сетчатые. Заземленными электродами служат в этом случае плоские металлические сетки, между которыми натянуты находящиеся под напряжением проволоки.
Быстрое развитие химии коллоидов обусловлено большим значением изучаемых этой наукой явлений для человеческой практики. Такие, казалось бы, совершенно различные вопросы, как жизненные процессы в организмах, образование в природе некоторых минералов, структура и урожайность почв и т. д., оказываются тесно связанными с коллоидным состоянием вещества. Коллоидная химия является также научной основой многих промышленных производств (искусственное волокно, пластические массы и т. д.).


