Щавелевая кислота
Эта кислота известна еще с XVII столетия. Она чрезвычайно распространена в природе. В виде щавелевокислого кальция (оксалата кальция) она содержится во всех растениях. Много кислой калиевой соли щавелевой кислоты находится в щавеле и кислице. В ничтожных количествах щавелевая кислота встречается и в животных организмах. Оксалат кальция содержится в виде осадка в моче человека при некоторых нарушениях обмена веществ.
Щавелевая кислота образуется часто при окислении, различных органических веществ. Раньше ее получали окислением древесных опилок кислородом воздуха при нагревании их с расплавленными едкими щелочами. При этом для прохождения реакции обязательно требуется присутствие хотя бы небольшого количества едкого кали; с чистым едким натром получение щавелевой кислоты невозможно. Окисление сахара азотной кислотой в присутствии пятиокиси ванадия как катализатора применяется и теперь для технического получения щавелевой кислоты
(отсюда и произошло в свое время название этой кислоты — «сахарная соль»). Другой промышленный способ получения щавелевой кислоты основан на том, что при быстром нагревании до 360° С формиат натрия (а также калия) отщепляет водород, превращаясь в оксалат натрия. Так как формиат натрия получается из окиси углерода и едких щелочей, то практически щавелевую кислоту можно получить непосредственно из этих веществ.
Существует много способов получения щавелевой кислоты, представляющих теоретический интерес. Например, при взаимодействии щелочных металлов с углекислым газом при 360° С получается соль щавелевой кислоты:
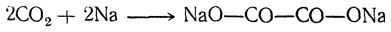
Щавелевая кислота получается при омылении дициана NC—CN и др.
При кристаллизации из воды щавелевая кислота обыкновенно получается в виде гидрата С2Н2О4 ∙ 2Н2О. Этот гидрат начинает диссоциировать уже выше 30° С. При очень быстром нагревании он плавится при 101,5° С. Безводная кислота в виде ромбических октаэдров может быть получена кристаллизацией из 70%-ной серной кислоты, а также высушиванием при осторожном нагревании (лучше — в вакууме). При возгонке щавелевая кислота получается в двух кристаллических формах: при низких температурах в вакууме — иглы, при более высоких — октаэдры. Безводная кислота плавится при 180° С с разложением.
Щавелевая кислота может быть окислена до углекислоты и воды:
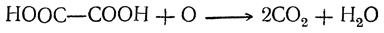
На этом основано применение щавелевой кислоты и ее солей как восстановителей, а также использование ее в анализе для установления титра растворов перманганата.
При нагревании щавелевая кислота разлагается (особенно легко в присутствии концентрированной серной кислоты) на окись углерода, углекислоту и воду:
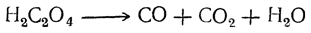
Таким образом, теоретически возможный ангидрид щавелевой кислоты оказывается неспособным к существованию.
Щавелевая кислота как двухосновная дает кислые и средние соли (оксалаты). Известны также и молекулярные соединения кислых оксалатов со щавелевой кислотой («тетраоксалаты»), как, например, кисличная соль КНС2О4 ∙ Н2С2О4 ∙ 2Н2О, употребляемая для выведения чернильных пятен.
Из солей щавелевой кислоты растворимы в воде лишь соли щелочных металлов. Щавелевокислый кальций нерастворим в воде и уксусной кислоте, но растворим в соляной кислоте; эти его свойства используются в качественном и количественном анализе для определения кальция. При обыкновенной температуре он кристаллизуется с одной молекулой воды, при более низких температурах — с тремя молекулами воды.
Щавелевая кислота легко дает комплексные соли, например K2[Fe(C2O4)2] и K3[Fe(C2O4)3]. В растворах этих солей содержатся комплексные ионы — двухзарядный ион Fe(C2O4)22– и трехзарядный ион Fe(C2O4)33–. Растворы первой из указанных солей имеют желтый цвет; эта соль применяется в качестве проявителя в фотографии.
Растворы второй соли окрашены в зеленый цвет.


