Бромэтан
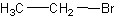
Синонимы:
этил бромистыйэтилбромид
Внешний вид:
бесцветн. жидкостьБрутто-формула (система Хилла): C2H5Br
Формула в виде текста: CH3CH2Br
Молекулярная масса (в а.е.м.): 108,97
Температура плавления (в °C): -125,5
Температура кипения (в °C): 38,4
Растворимость (в г/100 г или характеристика):
вода: 1,08 (0°C)вода: 0,96 (17,5°C)
вода: 0,914 (20°C)
диэтиловый эфир: смешивается
хлороформ: смешивается
этанол: смешивается
Метод получения 1.
(лабораторный синтез)Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. "Практикум по органической химии: Органический синтез" М.: Высшая школа, 1991 стр. 141-142
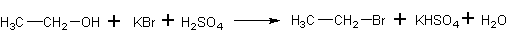
В круглодонную колбу (250 мл) помещают 28 мл концентрированной серной кислоты и быстро, охлаждая, при перемешивании приливают 28 мл этилового спирта. Теплую смесь при перемешивании и охлаждении колбы холодной водой разбавляют 20 мл ледяной воды, а затем прибавляют 25 г тонко растертого бромида калия. В реакционную колбу вставляют дефлегматор, снабженный термометром и длинным прямым водяным холодильником с алонжем. Конец алонжа на 1-1,5 см погружают в воду со льдом, налитую в колбу-приемник, и время от времени добавляют в нее кусочки льда. Через рубашку холодильника пропускают довольно сильную струю холодной воды.
Реакционную смесь нагревают на песчанной бане при 35-50 С до прекращения выделения маслянистых капель бромистого этила, скапливающихся на дне приемника. Если реакционная смесь в колбе начинает сильно пенится, то нагрев временно прекращают, а затем вновь возобновляют.
После окончания реакции содержимое приемника переливают в делительную воронку подходящего размера и после отстаивания сливают бромистый этил (нижний слой) в коническую колбу вместимостью 100 мл. Колбу хорошо охлаждают льдом с солью и при постоянном встряхивании прибавляют из капельной воронки по каплям концентрированную серную кислоту до тех пор, пока она не соберется в виде отдельного слоя под бромистым этилом. При обработке серной кислотой из бромистого этила извлекаются этиловый спирт, диэтиловый эфир и вода. Содержимое колбы переносят в сухую делительную воронку, отделяют нижний (сернокислотный) слой и отбрасывают его, а верхний слой (бромистый этил) переносят в колбу Вюрца. Перегонку сухого бромистого этила ведут на водяной бане, при этом приемник снаружи охлаждают водой со льдом. Собирают фракцию, отгоняющуюся в интервале 35-40 С (основная масса отгоняется при 38-39 С). Выход 26 г (50% от теоретического).
Метод получения 2.
(лабораторный синтез)Источник информации: "Синтезы органических препаратов" сб.1 М.1949 стр. 117-118
Литровую круглодонную трехгорлую колбу снабжают холодильником Аллина и капельной воронкой, ножка которой доходит до Дна колбы. Верхняя часть холодильника Аллина соединена с помощью согнутой стеклянной трубки с холодильником Либиха, конец которого погружен в смесь льда и соли (около 800 г), помещенную в стакан емк. в 2 л (примечание 1).
В реакционную колбу помещают363 г 95%-ного этилового спирта (7,5 мол.), 25 г красного фосфора и 15 г желтого фосфора (1,29 гр-ат.; примечание 2). Смесь нагревают на масляной бане до начала кипения (температура бани 100—110°), после чего через капельную воронку медленно в течение 3 час. добавляют 377 г брома (121 мл; 2,36 мол.; примечания 3 и 4). Затем спускают воду из холодильника Аллина и перегонку продолжают со скоростью 40—50 капель в минуту до тех пор, пока температура не повысится до 94° (вместо капельной воронки можно опустить в колбу термометр; температура бани около 155°). По окончании перегонки сперва снимают оба холодильника, а затем удаляют горелку (примечание 5).
Дестиллат промывают 20 мл 5%-ного раствора едкого натра, предварительно охлажденного до 0 , а затем 50 мл ледяной воды. Продукт сушат над безводным хлористым кальцием и перегоняют с коротким дефлегматором, причем дестиллат собирают в сухой приемник, охлаждаемый смесью льда и соли. Выход бесцветного бромистого этила с т. кип. 37—40° составляет 420—465 г (82—90% теоретич., считая на бром; примечание 6).
Примечания.
1. Схема прибора представлена на рисунке. 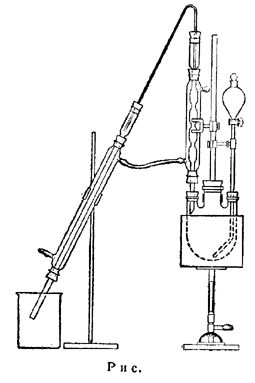
2. Примерно такие же хорошие выходы получают и при применении одного только желтого фосфора. Однако применение, наряду с желтым фосфором, некоторого количества красного фосфора ведет к более спокойному и легче контролируемому течению реакции. При работе с желтым фосфором необходимо соблюдать осторожность, так как на воздухе он самопроизвольно загорается. Его следует хранить под водой и быстро вносить в колбу, в которую предварительно налит спирт.
3. После начала прибавления брома происходит бурная реакция, вскипание жидкости и образование белых паров. По мере того как плотность паров уменьшается, скорость приливания брома можно увеличить настолько, чтобы часть белых паров доходила даже до холодильника Либиха.
4. Возможно, что вода будет засосана из бани с водой и льдом в прибор вследствие неожиданного изменения давления в системе. Этого затруднения можно избежать, если приливать бром с постоянной скоростью, сохранять постоянную скорость стекания флегмы и поддерживать температуру масляной бани на постоянном уровне так, чтобы изменение температуры и особенно ее понижение происходили медленно. Если воду засосет в реакционную колбу, прибавление брома можно прекратить, так как спирт станет разбавленным, в результате чего выход конечного продукта резко упадет.
5. Следует соблюдать осторожность при выливании остатка из колбы. Этот остаток иногда содержит непрореагировавший фосфор, который может самопроизвольно загореться на воздухе. По охлаждении остаток следует вылить в большое количество воды и смесь спустить в раковину, после чего промыть раковину сильной струей воды.
6. Вследствие большой летучести бромистого этила необходимо соблюдать осторожность при промывке, пользоваться только холодными жидкостями и следить за эффективностью холодильников.
Плотность:
1,4555 (20°C, г/см3)1,50138 (0°C, г/см3)
Показатель преломления (для D-линии натрия):
1,42386 (20°C)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-85,3 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
100,4 (ж)Температура вспышки в воздухе (°C):
-25Температура самовоспламенения на воздухе (°C):
455Теплота сгорания Qp (кДж/моль):
1424,8- Гитис С.С., Глаз А.И., Иванов А.В. "Практикум по органической химии: Органический синтез" М.: Высшая школа, 1991 стр. 142
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 197
