Метод молекулярных орбиталей (метод МО)
Отличие этого метода от метода электронных пар состоит в том, что в нем используются не волновые функции, описывающие электронные пары, а волновые функции одного электрона в поле всех ядер и остальных электронов. Электроны молекулы размещаются по соответствующим одноэлектронным уровням с учетом принципа Паули, т. е. на одной молекулярной орбите может находиться не более двух электронов, причем их спины должны быть противоположными.
Для молекулярных орбит характерно то, что отвечающие им функции являются многоцентровыми (в простейшем случае — двухцентровыми), а не одноцентровыми, как для атомных орбит.
Хотя приложение метода МО к многоатомным молекулам связано с определенными трудностями, в этом отношении уже сейчас достигнуты серьезные успехи. Для большого числа молекул получены характеристики π-электронных систем: полные энергии π-электронов, энергии отдельных молекулярных орбит, энергии возбуждения и т. д.
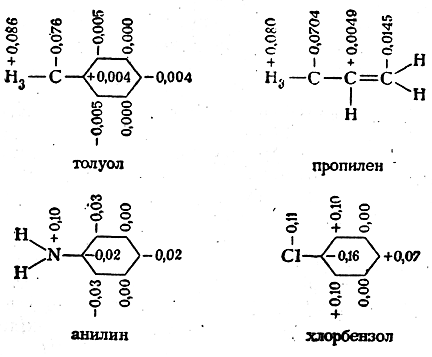
Метод молекулярных орбит успешно применяется для получения картины распределения π-электронной плотности в молекуле. В настоящее время для многих молекул рассчитаны так называемые молекулярные диаграммы, в которых указываются электронные, или эффективные, заряды, характеризующие относительную величину электронной плотности вокруг данного атома, кратности связей и индексы свободной валентности атомов, отражающие степень их ненасыщенности. На приведенных ниже молекулярных диаграммах толуола, пропилена, анилина и хлорбензола указаны значения электронной плотности у атомов углерода, азота, хлора:
На молекулярных диаграммах бензола и нафталина указаны эффективные заряды (в данных случаях равные нулю), кратности связей (цифры на линиях связей) и индексы свободной валентности атомов (показаны стрелками):
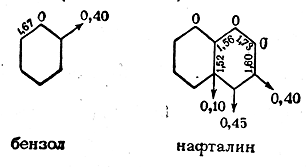
Такого рода диаграммы могут иметь важное значение для предсказания и объяснения реакционной способности органических соединений.
В последнее время по методу молекулярных орбит выполнены расчеты распределения σ-электронной плотности вмолекулах предельных соединений.


