§ 13. Соединения бария
Применение и токсичность соединений бария. Из соединений бария токсикологическое значение имеют его гидроксид, хлорид, нитрат, карбонат, хлорат и др.
Гидроксид бария, (баритовая вода) применяется в стекольном производстве и в производстве керамических изделий. Хлорид бария используется в кожевенной промышленности, в сельском хозяйстве для уничтожения вредителей растений. Карбонат бария применяется для уничтожения грызунов, а также в керамическом и стекольном производствах. Отмечены случаи отравлений людей карбонатом бария, содержащемся в качестве примеси в сульфате бария. При наличии этой примеси в сульфате бария, применяемом для рентгеноскопии желудка, под влиянием соляной кислоты желудочного сока происходит растворение карбоната бария с образованием хлорида бария, который всасывается в кровь и вызывает отравление. Нитрат и хлорат бария применяются в пиротехнике. Ацетат бария нашел применение в ситценабивном производстве. Ряд соединений бария применяется в качестве реактивов.
Растворимые соединения бария, поступившие в организм через пищевой канал, всасываются в желудке и вызывают отравление.
Проникновению в кровь растворимых в воде соединений бария препятствуют находящиеся в желудке сульфаты некоторых металлов. При этом образуется нерастворимый сульфат бария, не проникающий в кровь из желудка.
Соединения бария раздражают слизистые оболочки пищевого канала. При отравлениях соединениями бария может наступить перерождение печени. Смерть от соединений бария наступает в результате сердечно-сосудистой недостаточности. Патологоанатомическая картина отравлений барием не характерна.
Соединения бария выделяются из организма главным образом через кишки. Следы этих соединений выводятся через почки и частично откладываются в костях. Сведения о содержании бария как нормальной составной части клеток и тканей организма в литературе отсутствуют.
Исследование минерализатов на наличие бария
В химико-токсикологическом анализе для обнаружения соединений бария используется осадок BaSO 4, который может быть в минерализатах, полученных после разрушения биологического материала смесью серной и азотной кислот или смесью серной, азотной и хлорной кислот. Кроме осадка сульфата бария в мине-рализате может быть и осадок сульфата свинца. В ряде случаев осадки сульфатов бария и свинца могут быть загрязнены небольшим количеством ионов железа, меди, цинка, кадмия, олова, хрома и др. Эти примеси можно удалить из осадков промыванием их серной кислотой и водой. При наличии в осадке примесей ионов олова их удаляют промыванием осадка соляной кислотой.
Исследование осадка сульфата бария производят после отделения его от осадка сульфата свинца. Для разделения этих осадков их обрабатывают горячим раствором ацетата аммония, подкисленным уксусной кислотой. Для приготовления этого раствора берут 50 мл насыщенного раствора ацетата аммония, прибавляют 3 мл ледяной уксусной кислоты и 47 мл воды.
Осадок смеси сульфатов бария и свинца промывают 15—20 мл 0,2 н. раствора серной кислоты, а затем 10 мл воды. Промытый осадок на фильтре 2—3 раза обрабатывают горячим раствором ацетата аммония, подкисленным уксусной кислотой. При этом осадок сульфата бария остается на фильтре, а осадок сульфата свинца переходит в раствор (см. гл. VI, § 14).
В зависимости от величины осадка для растворения сульфата свинца берут 5—6 мл раствора ацетата аммония. При малых количествах осадка используется 1—2 мл указанного раствора.
Оставшийся на фильтре осадок используют для исследования его на наличие бария. С этой целью производят перекристаллизацию этого осадка в концентрированной серной кислоте, переводят указанный осадок в сульфид бария, а затем в иодат бария.
Перекристаллизация осадка сульфата бария. Часть исследуемого осадка наносят на предметное стекло и слегка подсушивают. Затем к осадку прибавляют 2—3 капли концентрированной серной кислоты и нагревают до появления белых паров БОз. При нагревании серная кислота не должна растекаться на предметном стекле. Если в осадке находится сульфат бария, то через 10—20 мин после охлаждения смеси на предметном стекле появляются бесцветные кристаллы, имеющие форму прямоугольников с вытянутыми углами или форму линз, собранных в виде крестов. Предел обнаружения: 0,05 мкг бария.
Реакция восстановления сульфата бария. На предметное стекло наносят несколько капель 5 н. раствора соляной кислоты. Затем с помощью платиновой петли забирают часть исследуемого осадка и нагревают его в восстановительной части пламени газовой или спиртовой горелки. При этом сульфат бария восстанавливается и образуется сульфид бария BaS. В результате этого пламя горелки окрашивается в зеленый цвет. Нагретую платиноьую петлю с осадком время, от времени опускают на несколько секунд в раствор соляной кислоты, находящейся на предметном стекле. Нагревание платиновой петли с осадком и смачивание его в соляной кислоте производят до тех пор, пока не наступит ослабление интенсивности окрашивания пламени. После этого в соляную кислоту, находящуюся на предметном стекле, опускают кристаллик иодата калия KIO 3. При этом образуются кристаллы иодата бария:
BaS + 2HCl + 2КIO 3 ---> Ва(IO 3 ) 2 + H 2 S + 2KCl
Окрашивание пламени горелки в зеленый цвет и появление на предметном стекле бесцветных призматических кристаллов иодата бария, собранных в виде сфероидов, указывает на наличие бария в исследуемом осадке. Предел обнаружения: 0,03 мкг бария в пробе.
Обнаружение ионов бария в его соединениях
Объектами исследования на наличие бария могут быть не только органы трупов и биологические жидкости, но и химические соединения этого металла, которые в народном хозяйстве широко используются для борьбы с вредителями сельскохозяйственных культур и для других целей.
Для обнаружения ионов бария в его соединениях применяют реакции с хроматом калия, серной кислотой, родизонатом натрия и др. Следует отметить, что с перечисленными реактивами дают осадки не только ионы бария, но и ионы стронция.
Реакция с хроматом калия. При взаимодействии ионов бария с хроматами образуется, светло-желтый осадок хромата бария, растворимый в минеральных кислотах и нерастворимый в уксусной кислоте. Осадок хромата бария образуется и при взаимодействии ионов бария с дихроматами:
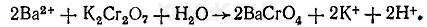
В связи с растворимостью осадка хромата бария в минеральных кислотах прибавляют ацетат натрия:
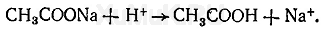
Образовавшаяся при этой реакции уксусная кислота не растворяет осадка хромата бария. Ионы стронция не мешают этой реакции, так как осадок хромата стронция растворяется в минеральных и уксусной кислотах.
Реакция с серной кислотой. От прибавления к ионам бария серной кислоты или растворимых в воде сульфатов выпадает белый осадок сульфата бария. Этой реакции мешают ионы стронция, которые в указанных условиях тоже дают белый осадок сульфата стронция, который не растворяется в кислотах.
Реакция с родизонатом натрия. Родизонат натрия с ионами бария образует красновато-коричневый осадок:
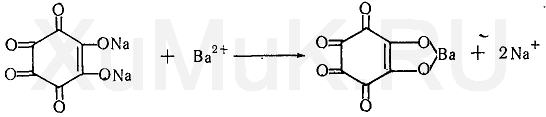
Этой реакции мешают ионы стронция, которые с родизонатом натрия тоже образуют красновато-коричневый осадок. Однако осадок родизоната стронция растворяется в соляной кислоте, а осадок родизоната бария под влиянием указанной кислоты переходит в нерастворимую кислую соль, имеющую ярко-красную окраску.
Выполнение реакции. На фильтровальную бумагу наносят каплю нейтрального или слегка кислого раствора анализируемого вещества и прибавляют каплю 0,2 %-го водного раствора родизоната натрия. При этом на бумаге появляется интенсивное пятно красновато-коричневого цвета. От прибавления капли разбавленной соляной кислоты пятно родизоната бария приобретает ярко-красную окраску, а красновато-коричневое пятно родизоната стронция исчезает. Предел обнаружения: 0,25 мкг бария в пробе.


