Маркировка поверхностей
Есть хорошо известный эксперимент: если губку, примитивное многоклеточное животное, расчленить до отдельных клеток, а затем оставить суспензию этих клеток в покое, то через некоторое время они вновь объединятся в многоклеточный организм. Если смешать суспензии клеток из губок двух различных видов, то при их объединении самопроизвольно возникнут два агрегата, каждый из которых состоит из клеток одного вида. Сходным образом ведут себя в культуре эмбриональные клетки высших животных: они объединяются порознь по тканевому признаку. Вопрос о том, каким образом клетки «узнают» друг друга, чрезвычайно важен не только для понимания их поведения в искусственных условиях подобных экспериментов. Взаимное опознание клеток играеи решающую роль уже на самых ранних стадиях развития зародыша многоклеточного организма, когда начинается формирование определенных типов тканей, а затем органов. Близкородственные аспекты межклеточных взаимодействий имеют непосредственное отношение к проблеме злокачественных опухолей, тканевой несовместимости, иммунитета и многим другим биологическим феноменам.
Если животные клетки в подходящей искусственной среде поместить на твердую поверхность (например, на дно чашки Петри), то их деление будет происходить упорядоченно: на поверхности растет одноклеточный слой, а после того, как вся она будет покрыта клетками, деление практически прекращается – наступает так называемое контактное торможение. В этом эксперименте проявляются в сильно упрощенном виде те явления, которые определяют постоянство размеров и формы органов и всего взрослого многоклеточного организма. По-иному ведут себя в таких экспериментах раковые клетки: они образуют бесформенную клеточную массу, их деление не приостанавливается после заполнения поверхности одноклеточным слоем. В отсутствии такого торможения заключена главная причина злокачественности – бесконтрольного роста опухоли. Целостность нормального органа поддерживается прочными межклеточными связями. В опухолях эти связи значительно слабее: отдельные их клетки легко отделяются от основной массы, уходят в кровяное русло и разносятся по всему телу. В этом первопричина метастазирования – второй грозной особенности злокачественных опухолей.
Очевидно, что во всех явлениях подобного типа соприкасающиеся поверхности клеток передают некоторый сигнал – команду на связывание клеток, на торможение деления и т.п. Долгое время о природе веществ, ответственных за такие межклеточные взаимодействия, а также за многие классы специфических взаимодействий типа клетка-макромолекула, ничего не было известно. Позднее стали накапливаться данные в пользу того, что во многих таких явлениях ключевая роль принадлежит углевода, находящимся на периферии клеток и макромолекул. Наиболее старым и хорошо изученным примером могут служить антигенные полисахариды многих бактерий. Например, капсула пневмококков, к числу которых относятся возбудители такого инфекционного заболевания, как пневмония, содержит значительные количества специфических полисахаридов. Именно на них вырабатывается иммунный ответ организма-хозяина. Доминирующая роль полисахаридов как антигенов таких бактерий доказана не только лабораторными, но и клиническими экспериментами. Так, еще во время второй мировой войны в американской армии была успешно осуществлена иммунизация большой группы людей против пневмонии путем введения им препаратов полисахаридов из пневмонийных бактерий.
Иммунная реакция – яркий пример взаимодействия типа клетка-макромолекула. По наиболее принятым сейчас представлениям упрощенная схема выработки иммунного ответа на бактериальный антиген такова. В лимфе и крови циркулируют специализированные клетки: Т- и В-лимфоциты, на поверхности которых находятся рецепторы к потенциальным антигенам. У каждого лимфоцита (точнее, у каждого клона, т.е. у семейства генетически тождественных лимфоцитов) имеются свои, индивидуальные для него рецепторы к потенциальным антигенам.
Разнообразие этих рецепторов (и клонов лимфоцитов) огромно: число различных рецепторов составляет величину порядка миллиона, так что практически на любой чужеродный биополимер (антиген) находится соответствующий ему рецептор. Зрелые В-лимфоциты, не соприкасавшиеся со «своими» антигенами (их называют «девственными» лимфоцитами), не делятся. Однако контакт с антигеном, например с бактериальным полисахаридом, служит сигналом для целой цепи событий. В-лимфоцит после этого трансформируется в плазматическую клетку и начинает делиться. Общее количество клеток данного клона резко возрастает; они начинают продуцировать и секретировать в кровь и лимфу большие количества свойственных этому клону иммуноглобулинов, т.е. антител, специфичных к данному антигену. Антитела реагируют с соответствующими антигенами в растворе, что приводит к их осаждению, и с теми же антигенами на поверхности бактериальной клетки. Таким образом происходят удаление бактериальных токсинов (антигенов) из организма и атака на клетки возбудителя, в чем и заключается защитный смысл иммунного ответа.
Механизм распознавания рецепторами и антителами своих антигенов почти неизвестен. Известно, однако, что это в высшей степени специфичное взаимодействие, так как его блокируют самые незначительные изменения в структуре углеводного антигена. Структурно измененный полисахарид или углеводсодержащий биополимер – это уже другой антиген; на него реагируют рецепторы других лимфоцитов и вырабатываются другие антитела.
При выработке иммунного ответа клеточные рецепторы реагируют на углеводные детерминанты макромолекулы антигена. Обратным примером может служить взаимодействие клеток с макромолекулами холерного токсина. Последний представляет собой белок, в состав которого входят две высокомолекулярные пептидные субъединицы. Одна из них ответственна за первичное взаимодействие с клетками организма-хозяина, а другая – за токсический эффект. Было установлено, что рецептором на поверхности клеток, осуществляющим узнавание молекулы токсина и связывание с ним, является гликолипид – ганглиозидG М1 , в молекуле которого к липидной части присоединен олигосахаридный фрагмент, содержащий остаток сиаловой кислоты. После присоединения токсина к ганглиозиду от первого отщепляется токсическая субъединица, под действием чего происходит ряд изменений в активности ферментов клетки, в первую очередь активация аденилат-циклазы, а это в конечном итоге приводит к крупным нарушениям клеточного метаболизма и гибели клетки.
Во многих случаях структура углеводных цепей, находящихся на поверхности клетки или макромолекулы, служит своеобразной маркировкой, кодирующей адрес, по которому они должны быть доставлены при транспортировке в организме. Так, например, в мембране эритроцитов имеются гликопротеины, на наружных концах углеводных цепей которых находятся остатки нейраминовой кислоты. При наличии этих остатков эритроцит достаточно долго циркулирует в кровяном русле, а при их удалении быстро уходит из него. Полагают поэтому, что концы цепей, обнажающихся при удалении остатков нейраминовой кислоты, служат участками связывания эритроцитов с мембранами кроветворных и выделительных органов.
«В связи с этим возникает предположение, согласно которому присоединение нейраминовой кислоты к гликопротеинам клеточной поверхности происходит в месте образования эритроцитов, например в костном мозге. Можно думать, что присоединение нейраминовой кислоты каким-то образом экранирует якорные участки эритроцита, т.е. реализуется команда «отдать концы» и корабль-эритроцит уходит в плаванье в кровоток».
Имеется ряд данных, указывающих на то, что в процессах клеточной дифференциации, т.е. при формировании тканей и органов в эмбриональной стадии, при специфической агрегации клеток (как в опытах с губками) большую информационную роль играют сульфатированные мукополисахариды – сложные биополимеры, в состав которых входят большой пептидный фрагмент и длинная полисахаридная цепь, включающая остатки уроновых кислот, аминосахаров и сульфата. Состав и структура этих соединений весьма индивидуальны не только для различных биологических видов, но и для различных тканей одного и того же организма.
Каков же все-таки механизм распознавания углеводных маркеров рецепторами поверхности клеток? В последние годы появилось одно чрезвычайно интересное объяснение такого феномена для ряда типов межклеточных взаимодействий. Чтобы его изложить, нужно напомнить некоторые положения энзимологии.
Ферменты – высоко специфичные катализаторы. Их специфичность двоякая. Во-первых, это субстратная специфичность, означающая, что фермент катализирует реакцию одного определенного вещества – субстрата, или по крайней мере субстратов, имеющих определенный общий элемент структуры. Во-вторых, это специфичность по реакции, суть которой в том, что из нескольких, а часто из многих реакций, в которые субстрат мог бы вступать в данных условиях, фермент катализирует только одну.
В активном центре фермента, т.е. в том месте белковой глобулы, в котором непосредственно осуществляется каталитический акт, имеется два участка с различными функциями. Участок связывания осуществляет соединение субстрата с ферментом и ориентацию его молекулы, оптимальную для осуществления основной реакции, но не участвует в реакции как таковой. Этот участок точно «настроен» на структуру субстрата и «ответствен» за субстратную специфичность. Природа связи между субсратом и участком связывания может быть очень различной; но для нас сейчас важно уяснить, что эта связь достаточно прочная. Продукт такого взаимодействия называется фермент-субстратным комплексом.
Второй участок в активном центре – каталитический. Его задача – осуществлять реакцию субстрата, ориентированного и подготовленного к этому в составе фермент-субстратного комплекса. После реакции субстрат в составе комплекса превращается в продукт, т.е. образуется фермент-продуктный комплекс, который легко диссоциирует. Продукт уходит в среду, а фермент регенерируется.
В обычных условиях ферментативной реакции фермент-субстратный комплекс – образование эфемерное, так как сразу же после его возникновения происходит основная реакция. Однако, если реакция по тем или иным причинам заторможена (например, при низкой температуре), то фермент-субстратный комплекс становится способным к длительному существованию. Такая ситуация возникает, в частности, для ферментативной реакции типа A+B à C+D при недостатке одного из субстратов. Например, фермент и субстрат А образуют нормальный комплекс, но в отсутствие субстрата В он не способен к дальнейшему превращению, и потому стабилен. Именно такой механизм образования стабильного фермент-субстратного комплекса, согласно излагаемой гипотезе, лежит в основе специфического, взаимного распознавания и сцепления клеток в ряде случаев межклеточных взаимодействий.
На поверхности таких клеток – на внешней стороне их мембран – находятся недостроенные углеводные цепи и ферменты (так называемые гликозил-трансферазы), переносящие на эту цепь недостающий моносахаридный остаток с предшественника – нуклеозид-дифосфат-сахара (НДФС), играющего при таком переносе роль второго субстрата. Однако в пределах одной клетки гликозил-трансферазы и их субстраты (недостроенные углеводные цепи) непосредственно взаимодействовать не могут, так как на мембране они пространственно разделены. Зато такое взаимодействие легко и эффективно осуществляется при контакте двух таких клеток: гликозил-трансфераза одной клетки образует фермент-субстратный комплекс с углеводной цепью другой клетки, и наоборот (рис. 9).
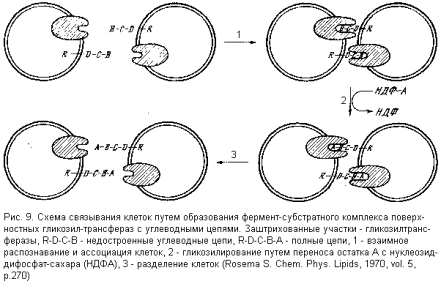
В отсутствие донора гликозильного остатка (НДФС) фермент-субстратные комплексы стабильны и связи между клетками прочны. При появлении же НДФС происходит достройка цепи и диссоциация комплекса, а следовательно, и связи между клетками. Такой механизм может превосходно объяснить высокую специфичность распознавания клетками друг друга и их ассоциирования, а также указывает путь тонкого регулирования взаимодействия: в отсутствие НДФС клетки ассоциируют, а при поступлении НДФС в межклеточное пространство диссоциируют. Такой механизм взаимодействия клеток позволяет понять, почему самые минимальные изменения в структуре углеводных цепей поверхности клетки решающим образом сказываются на ее взаимодействии с другими клетками или макромолекулами и на судьбе в организме (как в приводившемся выше примере с эритроцитами).
В настоящее время участие подобного механизма распознавания постулируют с различными степенями уверенности для целого ряда важнейших биологических явлений: формирования тканей и органов на эмбриональной стадии развития, взаимного опознавания некоторых половых клеток при оплодотворении, первичного акта тромбообразования – адгезии тромбоцитов на коллагеновых нитях (связывание гликозил-трансфераз тромбоцита с углеводными цепями коллагена), объяснения различий поведения нормальных и опухолевых клеток и др. Было, например, показано, что опухолевые клетки обладают повышенной способностью к переносу гликозильных остатков на концы цепей той же клетки, на которой находится данная гликозил-трансфераза. Отсюда – пониженная способность к ассоциированию и подавление контактного торможения.
Можно полагать, что описанные представления окажутся чрезвычайно плодотворными для решения многих общебиологических проблем, а применительно к углеводам послужат толчком для гораздо более глубокого изучения их информационных, сигнальных функций в живых организмах на молекулярном уровне.


