Химическая природа ферментов
В настоящее время получены неопровержимые экспериментальные доказательства белковой природы ферментов.
Трудно сейчас представить, что не только Р. Вильштеттер еще в 1926 г. отрицал принадлежность ферментов к белкам или к какому-либо известному классу органических веществ, но и совсем недавно высказывались сомнения на этот счет. Поводом для сомнений являлись опыты, в которых хотя и были получены ферментативно активные растворы, но белок не мог быть обнаружен при помощи качественных цветных реакций. Объясняется это тем, что концентрация фермента даже при высокой удельной активности оказывалась ниже пороговой чувствительности химического теста на белок.
О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства (антигенные, гормональные, каталитические). Под влиянием различных физических и химических факторов (воздействие УФ- и рентгеновского излучения, ультразвука, осаждение минеральными кислотами, щелочами, алкалоидными реактивами, солями тяжелых металлов и др.) происходит денатурация ферментов, так же как и белков.
Ферменты при гидролизе, как и белки, распадаются на аминокислоты, что, бесспорно, служит веским доказательством белковой природы ферментов.
Интересные данные, указывающие на белковую природу ферментов, были получены в лаборатории И.П. Павлова. При определении переваривающей способности желудочного сока была обнаружена прямая зависимость между этой способностью и количеством белка в соке. В связи с этим было сделано заключение, что пепсин желудочного сока является белком.
Вескими доказательствами белковой природы фермента являются его получение в чистом виде и выделение в форме кристаллов белка. К настоящему времени получено более 1000 кристаллических ферментов. Структура многих из них изучена детально при помощи современных методов химии белков и молекулярной физики [методами рентгеноструктурного анализа, ядерного магнитного резонанса (ЯМР), электронного парамагнитного резонанса (ЭПР) и др.].
Ферменты, как и все белки, обладают рядом свойств, характерных для высокомолекулярных соединений: амфотерностью (могут существовать в растворе в виде анионов, катионов и амфионов); электрофоретической подвижностью благодаря наличию в них положительных и отрицательных зарядов, а в изоэлектрической точке не обнаруживают подвижности в электрическом поле. Ферменты неспособны к диализу через полупроницаемые мембраны. При помощи диализа их растворы можно освободить от низкомолекулярных примесей. Как и белки, они легко осаждаются из водных растворов при низких температурах методами высаливания или осторожным добавлением ацетона, этанола и других веществ и при этом не теряют своих каталитических свойств.
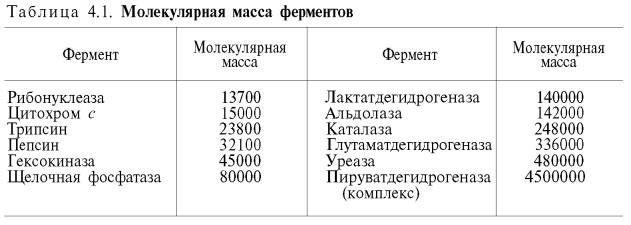
Подобно белкам, ферменты имеют большую молекулярную массу – от десятков тысяч до нескольких миллионов (табл. 4.1).
Ферменты оказывают высокоспецифическое действие, что также доказывает их белковую природу, поскольку белки в иммунологическом отношении отличаются крайне высокой специфичностью. Наконец, прямым доказательством белковой природы ферментов является лабораторный синтез первого фермента – рибонуклеазы, осуществленный в 1969 г. в лаборатории Б. Меррифилда в Нью-Йорке.
Этот автоматический синтез на твердой фазе состоял в последовательном включении всех 124 аминокислотных остатков в строгом соответствии с последовательностью аминокислот (с первичной структурой) естественного фермента – рибонуклеазы поджелудочной железы.
Искусственно синтезированный фермент не отличался от природной рибонуклеазы по химическим, каталитическим и иммунологическим тестам.
Принимая во внимание перечисленные обстоятельства, при получении ферментов в чистом виде и при их хранении следует учитывать одно важное свойство белков, а именно стабильность, которая определяется рядом факторов. Одним из общих правил при работе с ферментами является оптимальная температура, обычно соответствующая температуре тела, а для препаративных целей – использование температуры около 0°С.
Следует, однако, иметь в виду, что несколько ферментов, весьма чувствительных к пониженной температуре, в частности митохондриальный фермент (АТФаза), катализирующий распад АТФ, при 0°С подвергается инактивации, в то время как при комнатной температуре остается стабильным. Большинство ферментов сохраняет стабильность при рН 6,0–8,0, хотя имеются исключения. Для препаративных целей часто прибегают к обезвоживанию фермента (удаление воды) в вакууме из замороженного раствора (метод получил название «лиофилизация»). Осаждение из раствора фер ментов спиртом или ацетоном также проводят при низкой температуре поскольку при комнатной температуре эти процедуры приводят к почти полной потере ферментативной активности. Для стабилизации фермента часто пользуются хелатообразующими агентами: например, к ферменту добавляют этилендиаминтетраацетат (ЭДТА):
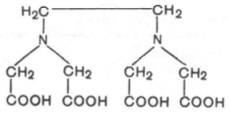
ЭДТА может связывать нежелательные примеси (следы ионов тяжелых металлов: меди, свинца, ртути и др. – в реактивах), тормозящие активность фермента. Одно из непременных условий сохранения стабильности ферментов – хранение их в высушенном или замороженном состоянии (в условиях холода). Многие ферменты стабильны в виде суспензии в концентрированных растворах сульфата аммония.


