Енамины
ЕНАМИНЫ, орг. соединения общей ф-лы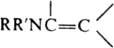
Первичные (R = R' = Н) и вторичные (R = Н) енамины могут находиться в таутомерном равновесии с соответствующими иминами, напр.:
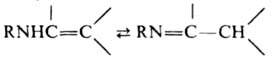
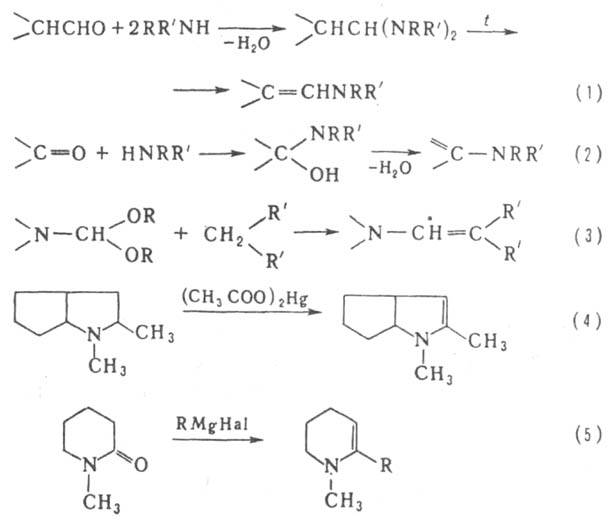
Енамины поглощают в УФ области при lмакс 220-235 нм (диенамины - ок. 280 нм); в ИК - при nмакс 1630-1650 см-1, причем при образовании солей (иммоний-катионов) эта полоса сдвигается в высокочастотную область на 20-50 см-1, что отличает енамины от b,g-ненасыщ. аминов. Енамины обычно получают взаимод. альдегидов и кетонов с вторичными аминами (р-ции 1 и 2 соотв.), амидацеталей с соед., имеющими активир. метиленовую группу (3), а также окислением третичных аминов (4) и из N-метиллактамов (5):
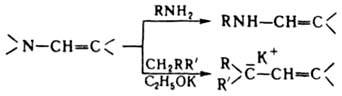
Специфич. р-ции енаминов обусловили их широкое использование в орг. синтезе. Протонирование и алкилирование енаминов может протекать по атому азота или по b-углеродному атому:
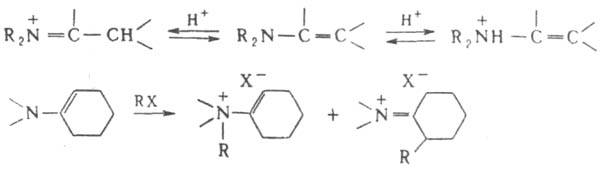
Енамины и образующиеся из них соли аммония легко гидролизуются до карбонильных соед., что в сочетании с b-алкилированием или b-ацилированием енаминов позволяет синтезировать замещенные карбонильные соед. (Сторка реакция):
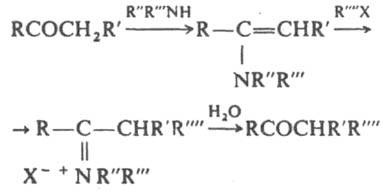
Енамины взаимодействуют с др. электроф. реагентами -a,b-ненасыщ. соед. (эфирами и нитрилами акриловой и кротоновой к-т, винилкетонами, акролеином), изоцианатами, кетеном, напр.:
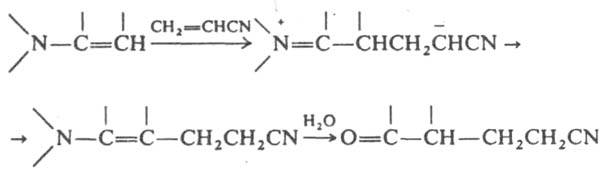
При галогенировании енаминов с послед. гидролизом образуются a-галогенальдегиды или a-галогенокетоны. В р-циях с электроф. реагентами чаще всего используют енамины, полученные из вторичных циклич. аминов - пирролидина, пиперидина и морфолина. Из р-ций енаминов с нуклеоф. реагентами следует отметить их взаимод. с первичными и вторичными аминами (переаминирование) и с соед., имеющими активир. метиленовую группу, напр.:
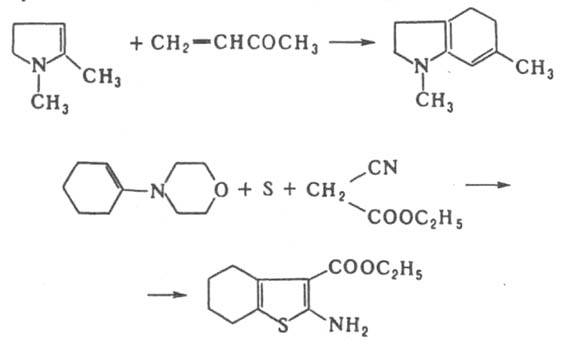
Енамины широко используют в синтезе гетероциклич. соед., напр.:
Литература
Общая органическая химия, пер. с англ., т. 3. М., 1982, с. 91-101,
Ещё по теме
Иононы — свойства и применение
Ионон — свойства и применение смеси изомеров
Нитроны — строение, свойства и применение
Хиноны — свойства и применение
Амидины — строение, свойства и применение
