Пуриновые основания
ПУРИНОВЫЕ ОСНОВАНИЯ, прир. производные пурина. Входят в качестве агликонов (неуглеводного компонента) в нуклеиновые к-ты, нуклеозиды, нуклеотиды; фрагменты коферментов, витаминов и др. Канонические пуриновые основания нуклеиновых к-т-аденин (6-аминопурин, сокращенно А) и гуанин (2-амино-6-пуринон, G). Разл. формы молекул пуриновых оснований, к-рые существуют при разных значениях рН, и таутомерные формы показаны на схеме:

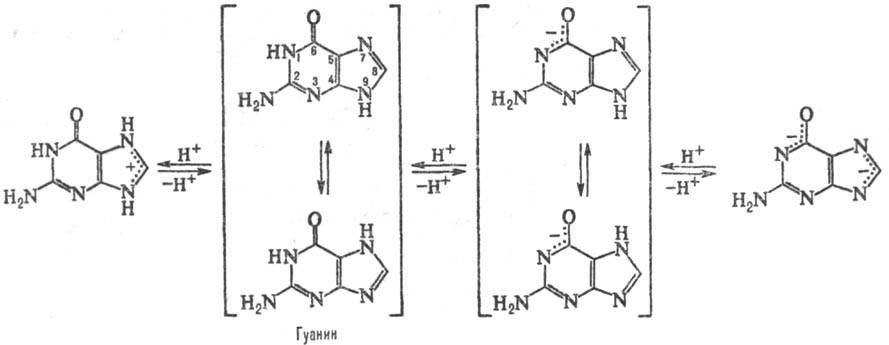
Кроме канонических пуриновых оснований в состав нуклеиновых к-т входят т. наз. минорные пуриновые основания (см. Минорные нуклеозиды), гл. обр. метилированные по экзоциклич. аминогруппе и (или) по атомам N гетероцикла. Эти основания образуются фермен-тативно в составе полинуклеотидов и играют важную роль в регуляции репликации и транскрипции, в защите клеток от чужеродных ДНК (см. Рестрикция и модификация ДНК)и системы трансляции от действия антибиотиков и др.
Образование специфич. водородных связей пуриновых оснований с пиримидиновыми основаниями в комплементарных участках цепей нуклеиновых к-т (см. Комплементарность), как и межплоскостные взаимод. между соседними основаниями в поли-нуклеотидной цепи, определяют формирование вторичной и третичной структур нуклеиновых к-т. В комплементарных участках помимо канонич. пар пуриновых оснований с пиримидиновыми основаниями (А-Т и G-С; Т и С-соотв. цитозин и тимин) могут образовываться неканонич. пары (G-G, G-A, G-T и др.).
Последовательность пуриновых и пиримидиновых оснований в полинуклеотидной цепи определяет генетич. информацию, заключенную в ДНК, вирусных и матричных РНК.

Дезаминирование аденина в составе поли-нуклеотида (превращение в гипоксантин) меняет информац. смысл и приводит к точковой мутации. Дезаминирование гуанина (превращение его в ксантин) в составе матричных полинуклеотидов приводит к блокированию репликации и транскрипции. Метилирование пуриновых оснований по N-7 в составе матричных полинуклеотидов не сопровождается изменением генетич. смысла основания.
Пуриновые основания представляют собой высокоплавкие (т. пл. > 250 °С), бесцв. кристаллич. соед., плохо раств. в горячей воде (особенно гуанин), не раств. в этаноле и диэтиловом эфире. Содержание редких таутомерных форм (иминотаутоме-ры А и G по С-6 и С-2 соотв., енольного таутомера G по С-6) не превышает в норм. условиях 10-3%. Протонирование и депротонирование пуриновых оснований сопровождается изменениями УФ спектров поглощения (см. табл.) и реакц. способности.
Хорошо изучены р-ции ацилирования и дез-аминирования экзоциклич. аминогрупп пуриновых оснований действием азотистой к-ты и замещение аминогруппы аденина при действии гидроксил-аминов. Алкилирование пуриновых оснований идет по атомам N циклов (реакц. способность уменьшается в ряду: N-9 > N-7 > > N-3 > N-1), по экзоциклич. аминогруппам и по атому О-6 гуанина. Возможно прямое га-логенирование по атому С-8. При действии орг надкислот на аденин образуются N-оксиды по атомам N имида - зольного цикла. При действии формальдегида образуются N-ме-тилольные соединения. Хлор- и бромацетальдегид избирательно реагирует с аденином, образуя т. наз. этеноаденин в результате взаимод. альдегидной группы с аминогруппой аденина и последующего N-1 алкилирования с участием а-атома С реагента. Глиоксаль и кетоксаль избирательно реагируют с гуанином, образуя третий гетероцикл в результате р-ций карбонильных групп агента с экзоциклич. аминогруппой и атомом N-1. Скорости всех этих р-ций весьма существенно зависят от локальных особенностей высшей структуры полинуклеотида, что широко используют для изучения вторичной и третичной структур нуклеиновых к-т. Канонические и минорные пуриновые основания могут быть получены препаративно из нуклеиновых к-т путем кислотного гидролиза и послед. разделения. Гуанин в больших кол-вах получают из рыбьей чешуи.
Лит. см. при ст. Муимидиновые основания. Э. И. Будовский.
