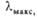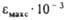Пиримидиновые основания
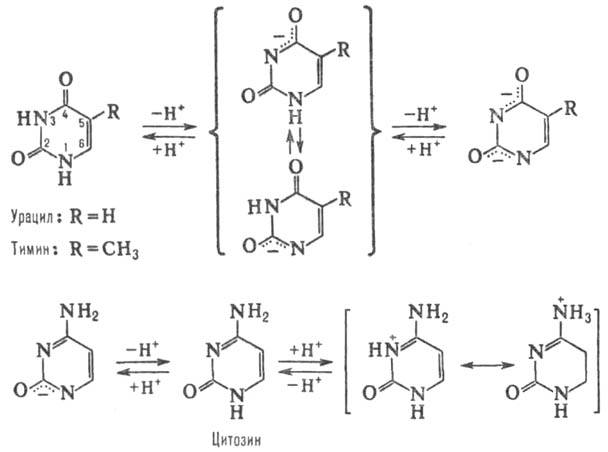
ПИРИМИДИНОВЫЕ ОСНОВАНИЯ, производные пиримидина, входящие в состав нуклеиновых к-т, нуклео-тидов, коферментов и др. Канонич. пиримидиновые основания -цитозин (4-амино-2-пиримидон, сокращенно С), тимин (3-метил-пиримидин-2,4-дион, T) и урацил (пиримидин-2,4-дион, U); разл. формы молекул. Пиримидиновые основания (они существуют при разных значениях рН) показаны на схеме.
Кроме канонических пиримидиновых оснований в состав нуклеиновых к-т входят т. наз. минорные пиримидиновые основания (см. Минорные нуклеозиды), гл. обр. замещенные по атому С-5-5-метил- и 5-гидроксиме-тилцитозин, 5-карбоксиметилурацил, а также 5,6-дигидро-урацил, N4-метилцитозин и др.
Специфич. наборы водородных связей между пирими-диновыми и пуриновыми основаниями в комплементарных участках цепей (см. Комплементарностъ), а также межплоскостные взаимод. между соседними основаниями в цепи определяют формирование и стабилизацию вторичной и третичной структуры нуклеиновых к-т. Последовательность пуриновых и пиримидиновых оснований в полинуклеотидной цепи определяет генетич. информацию ДНК и матричных РНК. Модификация пиримидиновых оснований в полинуклеотидах под воздействием мутагенов может приводить к изменению информац. смысла (точковой мутации).
Пиримидиновые основания представляют собой высокоплавкие (т. пл. 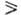 300 0C) бесцв. кристаллич. соед., умеренно раств. в горячей воде, не раств. в этаноле и диэтиловом эфире. Существуют в тауто-мерных формах (константы таутомерного равновесия
300 0C) бесцв. кристаллич. соед., умеренно раств. в горячей воде, не раств. в этаноле и диэтиловом эфире. Существуют в тауто-мерных формах (константы таутомерного равновесия 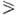 105), напр.:
105), напр.:
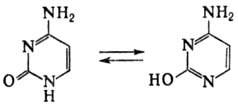

| Основание | Мол. м | УФ спектры | pKa | ||||
| Форма молекулы | нм | | |||||
| Цитозин | 111,1 | 275 | 10,03 | 4,5-4,7; | |||
| нейтральная | 268 | 6,09 | 12,1-12,3 | ||||
| 283 | 8,09 | | |||||
| Урацил | 112,1 | нейтральная | 258 | 8,20 | 9,35-9,50; | ||
| моноанион | 282 | 5,90 | 13,9 | ||||
| дианион | 273 | 7,17 | | ||||
| Тимин | 126,1 | центральная | 265 | 7,90 | 9,9; 13,9 | ||
| моноанион | 293 | 5,19 | | ||||
| дианион | 280 | 5,97 | | ||||
Наиб. характерные р-ции пиримидиновых оснований с нуклеофилами - присоединение по связи C=C (гидросульфита, гидроксиламина, галогена и др.) и замещение экзоциклич. аминогруппы цитозина (напр., р-ции с гидроксиламинами, гидразинами). Последняя р-ция значительно облегчается при насыщении связи C=C. Восстановление двойной связи C=C легко осуществляется путем каталитич. гидрирования или действием NaBH4 при УФ облучении. Атом H у С-5 легко замещается на гидрокси- или аминометильную группу, галоген. При действии P2S5 один или оба атома О в урациле и тимине могут замещаться на атом S. При действии на цитозин HNO2 происходит его дезаминирование с образованием урацила.
Р-ции пиримидиновых оснований с электроф. реагентами (наиб. изучено алкилирование) идут преим. по атомам N-1 и N-3, в меньшей степени - по экзоциклич. аминогруппе цитозина. В щелочной среде идет также алкилирование по атомам О. Довольно легко протекает ацилирование аминогруппы цитозина.
При радиолизе водных р-ров пиримидиновых оснований образуются 5,6-дигид-рокси-, 5-гидрокси-6-гидроперокси- и 5-гидроперокси-6-гидрокси-5,6-дигидропиримидины и продукты их дальнейших превращений. Действие УФ излучения (l > 200 нм) на водные р-ры пиримидиновых оснований приводит к образованию 5,6-дигидро-6-гидроксипиримидинов (фотогидратов), циклобутановых димеров (через триплетное состояние) с раскрытием связей C=C, нециклобутановых димеров пиримидиновых оснований (через нижнее синглетное возбужденное состояние). Фотогидраты спонтанно превращ. в исходные соед., а циклобутановые димеры дедимеризуются фотохимически.
Различие реакц. способности пиримидиновых оснований позволяет избирательно модифицировать их в составе полинуклеотидов. Такие р-ции лежат в основе определения нуклеотидной последовательности (первичной структуры) нуклеиновых к-т. Взаимод. с соседними основаниями, зависящие от локальной высшей структуры полинуклеотидов, оказывают влияние на скорость модификации пиримидиновых оснований при действии разл. агентов. В связи с этим сопоставление относит. скоростей модификации пиримидиновых оснований используется для изучения вторичной и третичной структуры нуклеиновых к-т.
Как канонические, так и минорные пиримидиновые основания обычно получают препаративно из нуклеиновых к-т путем кислотного гидролиза и послед. разделения.
Лит.: Кочетков H. К. [и др.], Органическая химия нуклеиновых кислот, M., 1970; Бородавкин А. В. [и др.], Электронная структура, УФ-спектры поглощения и реакционная способность компонентов нуклеиновых кислот, в сб.: Итоги науки и техники, сер. Молекулярная биология, т. 14, M., 1977; Шаба-ров а 3. А., Богданов А. А., Химия нуклеиновых кислот и их компонентов, M., 1978; Photochemistry and photobiology of nucleic acids, v. 1 (Chemistry), ed. by Shi Yi Wang. N. Y., 1976. Э.И. Будовский.