Тромбин
ТРОМБИН (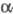 -тромбин), фермент класса гидролаз (серино-вая протеаза), катализирующий гидролиз пептидных связей, образованных остатками аргинина и лизина (обладает ограниченной субстратной специфичностью).
-тромбин), фермент класса гидролаз (серино-вая протеаза), катализирующий гидролиз пептидных связей, образованных остатками аргинина и лизина (обладает ограниченной субстратной специфичностью).
Тромбин играет ключевую роль в системе свертывания крови -катализирует превращение фибриногена в фибрин, осуществляет активацию разл. факторов свертывания крови. (см. Протромбиновый комплекс), стимулирует активацию тромбоцитов, эндотелиальных (выстилают внутр. стенки кровеносных и лимфатич. сосудов, полостей сердца) и гладкомышечных клеток. Тромбин проявляет также неферментативные (гормо-ноподобные) св-ва - связывается с рецепторами лейкоцитов, стимулируя хемотаксис (направленное движение клеток, обусловленное градиентом концентрации хим. B-B).
Тромбин вовлекается в процессы заживления ран, функционирует как сильное ангиогенное (воздействующее на кровеносные сосуды) и митогенное (стимулирует деление клеток) ср-во; участвует в разл. патологич. процессах, таких, как тромбозы, атеросклероз, рак и др.
Молекула тромбина человека (мол. м. ок. 40 тыс.) состоит из двух пептидных цепей (А и Б), содержащих соотв. 36 и 259 аминокислотных остатков, связанных одной дисульфидной связью. Каталитич. участок активного центра фермента расположен в Б цепи, аминокислотная последовательность к-рой гомологична структуре трипсина, химотрипсина и эластазы (фермент, катализирующий гидролиз белка эластина -компонента волокна соединит. ткани). Каталитич. центр тромбина содержит характерный для сериновых протеаз фрагмент  (букв. обозначения см. в ст. Аминокислоты).
(букв. обозначения см. в ст. Аминокислоты).
Молекула тромбина содержит два анионсвязывающих участка, один из к-рых расположен вблизи каталитич. центра и ответствен за "узнавание" фибриногена. Со вторым связываются гепарин и др. полисахариды, а также гирудин (белок, вырабатываемый слюнными железами мед. пиявок; состоит из 65 аминокислотных остатков) и клеточные мембраны.
Неполярный участок связывания, расположенный вблизи каталитич. центра тромбина, обусловливает преим. расщепление ферментом субстратов, содержащих пептидные связи, образованные аргинином и лизином, непосредственно связанными с остатком пролина или с др. неполярными остатками аминокислот. Вблизи каталитич. центра располагается уникальная аминокислотная последовательность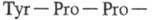
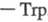 , к-рая обеспечивает хемотоксич. св-ва тромбина в отношении лейкоцитов. Аминокислотная последовательность
, к-рая обеспечивает хемотоксич. св-ва тромбина в отношении лейкоцитов. Аминокислотная последовательность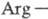
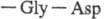 участвует в связывании тромбина с клеточными рецепторами. Кроме того, тромбин содержит углеводную компоненту, функцион. роль к-рой не выяснена.
участвует в связывании тромбина с клеточными рецепторами. Кроме того, тромбин содержит углеводную компоненту, функцион. роль к-рой не выяснена.
Тромбин образуется из протромбина в результате его активации. Ингибиторы тромбина - белки плазмы крови антитромбин III (мол. м. ок. 65 тыс.), 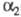 -макроглобулин (мол. м. ок. 725 тыс.) и нек-рые др.; наиб. ингибирующим действием обладает ги-рудин.
-макроглобулин (мол. м. ок. 725 тыс.) и нек-рые др.; наиб. ингибирующим действием обладает ги-рудин.
Лит.: Овчинников Ю.А., Биоорганическая химия, M., 1987, с. 233-34; Fenton J. W. П, "Seminars of Thrombosis and Hemostasis", 1988, № 14, p. 234-40; там же, 1989, № 15, p. 265-68. И. П. Баскова.
