Хрома оксиды
ХРОМА ОКСИДЫ. В системе Сr-О (рис.) существуют оксиды СrО, СrО2, Сr2О3 и др., св-ва хрома оксидов сопоставлены в табл. Низший оксид СrО метастабилен, его точка состава в системе Сr-Сr2О3 попадает в область расслаивания расплава, к-рая простирается от 2 до 48 ат.% О. В этой системе обнаруживается также инконгруэнтно плавящийся оксид Сr3О4, существующий при т-рах выше ~ 1550 °С. Он имеет искаженную структуру шпинели.
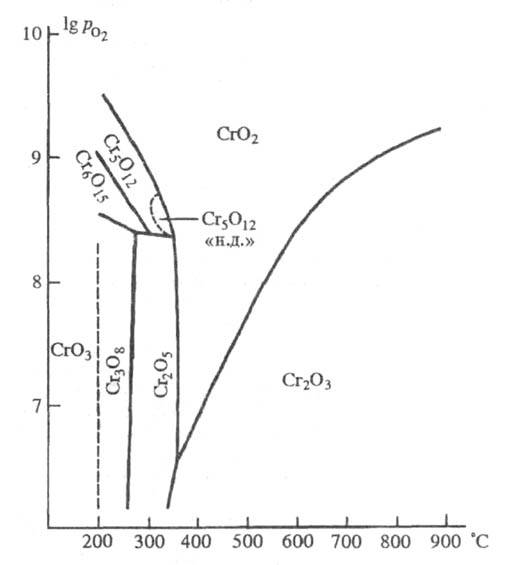
Области устойчивости оксидов хрома: - давление кислорода (Па); "н.д." - низкого давления.
- давление кислорода (Па); "н.д." - низкого давления.
СrО - красные кристаллы или черный пирофорный порошок; кристаллич. СrО устойчив на воздухе, не раств. в воде, но интенсивно окисляется выше ~ 100 °С. Реагирует с НС1 с выделением водорода, с разб. HNO3 и H2SO4 не взаимодействует. Получают СrО термич. разложением карбонила Сr(СО)6. Используют как адсорбент для очистки углеводородов от О2.
Гидроксид Сr(ОН)2 коричневого или желтого цвета осаждается из р-ров солей Сr(II) щелочами в отсутствие кислорода; произведение р-римости 2,0 x 10-20; не раств. в р-рах щелочей и разб. к-тах, медленно раств. в конц. к-тах; на воздухе быстро окисляется.
Оксид Сr(III) (сесквиоксид) Сr2О3 (минерал эсколаит) имеет структуру типа корунда (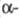 форма). Его цвет меняется от светло-зеленого у тонкодисперсного материала до почти черного у больших кристаллов. При нагр. зеленый цвет обратимо переходит в коричневый. Существуют аморфный Сr2О3, а также метастабильная кубич.
форма). Его цвет меняется от светло-зеленого у тонкодисперсного материала до почти черного у больших кристаллов. При нагр. зеленый цвет обратимо переходит в коричневый. Существуют аморфный Сr2О3, а также метастабильная кубич.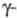 форма со структурой типа шпинели (а = 0,836 нм) коричневого цвета. Описана также тетрагон. модификация (а = 0,9480 нм, с = 0,5160 нм), по-видимому, устойчивая выше 1000 °С. Сr2О3 заметно летуч выше ~ 1200 °С; испаряется конгруэнтно, с диссоциацией в парах; ур-ние температурной зависимости давления пара lgp (мм рт. ст.) = 10,62 - 25300/Т (1504 - 1821 К); парамагнетик, при 32 К (точка Нееля) переходит в антиферромагн. состояние,
форма со структурой типа шпинели (а = 0,836 нм) коричневого цвета. Описана также тетрагон. модификация (а = 0,9480 нм, с = 0,5160 нм), по-видимому, устойчивая выше 1000 °С. Сr2О3 заметно летуч выше ~ 1200 °С; испаряется конгруэнтно, с диссоциацией в парах; ур-ние температурной зависимости давления пара lgp (мм рт. ст.) = 10,62 - 25300/Т (1504 - 1821 К); парамагнетик, при 32 К (точка Нееля) переходит в антиферромагн. состояние, перехода 0,80 кДж/моль; полупроводник, ширина запрещенной зоны ~ 3,4 эВ; твердость по шкале Мооса 9.
перехода 0,80 кДж/моль; полупроводник, ширина запрещенной зоны ~ 3,4 эВ; твердость по шкале Мооса 9.
СВОЙСТВА ОКСИДОВ ХРОМА
| Показатель | СrO | Сr3O4 | Сr2O3 | СrO2 | Сr5O12 | Сr2O5 | Cr6O15 | Сr3O8 | СrO3 |
| Цвет | Красный | Оранжевый | Зеленый | Черный | Черный | Черный | Черный | Коричневый | Красный |
| Сингония | Кубич. | Тетрагон. | Тритон. | Тетрагон. | Ромбич. | Моноклинная | Ромбич. | Ромбич. | Ромбич. |
| Параметры яейки: a, нм | 0,412 | 0,62026 | 0,49576 | 0,4422 | 1,2044 | 1,201 | 0,847 | 1,201 | 0,8525 |
| b, нм | — | — | — | — | 0,8212 | 0,852 | 1,290 | 2,660 | 0,4755 |
| с,нм | — | 0,85386 | 1,35874 | 0,2918 | 0,8177 | 0,929 | 1,008 | 0,782 | 0,4743 |
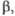 град град | — | — | — | 92,0 | — | — | — | ||
| z | 4 | 8 | 6 | 2 | 4 | — | 4 | — | — |
| Пространств. группа | Fт3т | — | 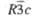 | P42/mcc | Рbсп | — | Стсm | — | C2cm |
| Т. пл., °С | 1550 | 1705* | 2334** | — | — | — | — | — | — |
| Плотн., г/см3 | — | — | 5,21 | 4,95 | 3,68 | — | 3,34 | — | 2,82 |
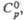 Дж/(моль x К) Дж/(моль x К) | — | — | 119 | — | — | — | — | 58 | |
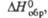 кДж/моль кДж/моль | -335 | -1447 | -1141 | -588,3 | -2890 | -1200 | — | -1791 | -590 |
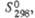 Дж/(моль x К) Дж/(моль x К) | 61 | 150,5 | 81 | 48,1 | 281 | 116 | — | 183 | 73,2 |
*Инконгруэнтно. **Т. кип. 3000 oС.
Сr2О3 химически малоактивен. Не раств. в воде и орг. р-рителях, не взаимод. с р-рами щелочей, раств. в сильных к-тах лишь при длительном нагревании, окисляется и переходит в р-р при действии горячих р-ров персульфатов или хлоратов, а также 70%-ной НС1О4. Окисляется расплавами KNO3 и КС1О3, взаимод. с расплавами щелочей на воздухе. При спекании с оксидами или карбонатами металлов образует хромиты (см. Хромоты). Взаимод. с хлором в присут. углерода при 650-850 °С. Выше ~ 1500 °С восстанавливается до металла действием Н2, С, СО, Si, Al, Ca, Mg и т. п.
Получают Сr2О3 термич. разложением гидроксида или гидратированного хромихромата (см. ниже), СrО3, (NH4)2Cr2O7, прокаливанием дихроматов Na или К с углем с послед. выщелачиванием, сжиганием Сr в О2. Оксид высокой частоты рекомендовано получать окислением хроморг. соед., напр. этилбензолхрома. Используют Сr2О3 для получения металлич. хрома и его карбидов, как пигмент, катализатор орг. синтеза (окисление, крекинг, гидрирование и дегидрирование), как полировальный материал, компонент огнеупоров, ферритов.
Известен ряд гидроксидов Сr(III). При действии на водные р-ры солей Сr(III) щелочи или аммиака образуется гелеобразный осадок Cr(OH)3 x nH2O. Р-римость гидроксида в воде 1-10-7% по массе при 25 °С. Окраска его (голубая, зеленая, зеленовато-черная или фиолетовая), а также хим. активность зависят от условий осаждения. Гидроксид легко раств. в минеральных к-тах и р-рах щелочей. По мере старения осадков их реакционная способность падает. При высушивании осадков образуется гидрат Сr(ОН)3 x ЗН2О, к-рый м. б. получен в кристаллич. виде; структура гексагoн. (а = 1,230 нм, с = 0,970 нм, z = 8; по др. данным, а = 0,531 нм, с = 0,487 нм); плотн. 1,64 г/см3. Малоустойчив, при хранении, а также при нагр. до ~ 70 °С переходит в аморфный гидрат Сr2О3 x 5Н2О, устойчивый до ~ 85 °С. При дальнейшем обезвоживании получают аморфный гидроксид Сr(ОН)3. Кристаллизуется он в структуре типа байерита А1(ОН)3, решетка гексагoн. (а = 0,5288 нм, с = 0,4871 нм, z = 2);плотн. 2,90 г/см3; обезвоживается ок. 150 °С. Применяют гидроксид для получения солей Сr(III), катализаторов, ферритов.
Известен также гидрат - изумрудная зелень, или зелень Гийе, состава Сr2О3 x пН2О, где п изменяется от 1,5 до 2; не раств. в минеральных к-тах, р-рах щелочей, легко раств. в р-рах СrО3. Устойчив на воздухе. При нагр. до ~ 200 °С теряет большую часть воды (остается 0,5 Н2О), но при выдержке на воздухе снова ее поглощает. Полностью обезвоживается ок. 600 °С. Получают прокаливанием смеси К2Сr2О7 с Н3ВО3 при 500-600 °С с послед. выщелачиванием, нагреванием гидроксида Сг в автоклаве с добавкой борной или кремниевой к-ты или восстановлением Na2Cr2O7 орг. в-вами (напр., мелассой) в автоклаве. Применяют как пигмент.
Оксогидроксид СrOОН (или Сr2О3 x Н2О) известен в виде неск. модификаций. Модификация (минерал гримальдит) образует кристаллы голубовато-серого, голубовато-зеленого или коричнево-красного цвета; имеет ромбоэдрич. структуру (а = 0,2960 нм, с =1,329 нм, z = 3, пространств. группа
Модификация (минерал гримальдит) образует кристаллы голубовато-серого, голубовато-зеленого или коричнево-красного цвета; имеет ромбоэдрич. структуру (а = 0,2960 нм, с =1,329 нм, z = 3, пространств. группа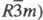 ; плотн. 4,12 г/см.
; плотн. 4,12 г/см. Модификация зеленого цвета (минерал гвианаит) имеет ромбич. решетку (а = 0,4861 нм, b = 0,4292 нм, с =0,2960 нм, z = 2, пространств, группа Рптп); плотн. 4,57 г/см3. Третья модификация (минерал бресуэллит) красно-коричневого цвета имеет ромбич. структуру типа диаспора (а = 0,449 нм, b = 0,986 нм, с = 0,297 нм, z = 4, пространств, группа Рbпт). Описана изумрудно-зеленая
Модификация зеленого цвета (минерал гвианаит) имеет ромбич. решетку (а = 0,4861 нм, b = 0,4292 нм, с =0,2960 нм, z = 2, пространств, группа Рптп); плотн. 4,57 г/см3. Третья модификация (минерал бресуэллит) красно-коричневого цвета имеет ромбич. структуру типа диаспора (а = 0,449 нм, b = 0,986 нм, с = 0,297 нм, z = 4, пространств, группа Рbпт). Описана изумрудно-зеленая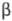 -модификация, тоже ромбическая, со структурой типа бемита (пространств. группа Стст). Есть указания на существование еще одной, кубической, модификации серо-фиолетового цвета.
-модификация, тоже ромбическая, со структурой типа бемита (пространств. группа Стст). Есть указания на существование еще одной, кубической, модификации серо-фиолетового цвета.
Оксогидроксид устойчив на воздухе, практически не реагирует с минеральными к-тами и р-рами щелочей. Поведение при нагр. различается у разных модификаций. Обезвоживание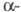 формы происходит при 370-440 °С,
формы происходит при 370-440 °С,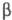 -модификации - при 480-550 °С,
-модификации - при 480-550 °С,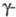 модификации - при 520-570 °С. Образуется СЮОН при неполном обезвоживании гидроксида Сr(III). Промежут. продукт при получении Сr2О3.
модификации - при 520-570 °С. Образуется СЮОН при неполном обезвоживании гидроксида Сr(III). Промежут. продукт при получении Сr2О3.
Диоксид СrО2 кристаллизуется в структуре типа рутила; по нек-рым данным, имеет область однородности (отношение О:Сr от 1,901 до 2,013); ферромагнетик, обладает металлич. проводимостью; при 110 °С переходит в парамагн. состояние (без изменения структуры). При ~ 510°С разлагается до Сr2О3. На воздухе устойчив, при длительном кипячении в воде диспропорционирует на СrOОН и Н2СrО4. При действии соляной к-ты окисляет ее с выделением С12. Получают СrО2 разложением СrО3 или Сr5О12 либо Сr3О8 в гидротермальных условиях; рабочее в-во носителей магн. записи.
Известна аморфная парамагн. форма СrO2 коричневого или черного цвета. Она содержит следы воды и обычно немного меньше кислорода; ее ф-лу иногда пишут Cr5O9 x aq. При полном обезвоживании разлагается. Как гидрат диоксида можно рассматривать гидроксохромат [Сr(ОН)2]2СrO4, к-рый выпадает из р-ров, содержащих Сr(III) и Cr(VI) при рН 3-4; коричневое рентгеноаморфное в-во, содержащее дополнительно 5-5,5 молекул воды; полупродукт при получении нек-рых соединений Сr.
Описаны гидроксохроматы Сr(III) - это Сr(ОН)2(НСrO4) x 4Н2О (при стоянии с маточным р-ром он превращается в СrО2 x 2Н2О) и Сr5(ОН)9(СrO4)3 x пН2О. Все они аморфные, легко раств. в разб. минеральных к-тах и р-рах щелочей, при нагр. обезвоживаются и при ~ 250 °С разлагаются. Гидроксохроматы хрома(III) общей ф-лы xСr2О3 x yСrО3 x nН2О часто наз. хромихроматами.
Указывалось на существование оксидов Сr4О7 и Сr6О11.
Оксид Сr5О12 - хромат (VI) хрома (III). По-видимому, это фаза переменного состава, чья область однородности лежит в интервале составов СrO2,4 - СrО2,48 (по др. данным, от СrO2,385 до CrO2,430). Мелкие черные иглы. Не раств. в воде, раств. в разб. минеральных к-тах; оксид, полученный при высоких давлениях, разлагается конц. H2SO4 при кипячении. Приведенные в табл. структурные параметры относятся к неферромагн. модификации высокого давления. Структура ферромагн. (плотн. 3,29 г/см3) модификации низкого давления не изучена.
Оксид Сr2О5 также содержит хром в двух степенях окисления, его структурная ф-ла Сr2(СrО4)2(Сr2О7). Описаны две его модификации - моноклинная антиферромагнитная с т-рой Нееля ниже 80 К и существующая при высоких давлениях ромбическая, для к-рой предложена ф-ла Сr6О15. Это черные пластинчатые кристаллы. Не реагирует с водой и разб. к-тами, раств. в конц. H2SO4 при комнатной т-ре. Получается при термич. разложении СrО3 или Cr3O8 в атмосфере О2 (270-300 oС).
Как гидрат Сr2О5 можно рассматривать гидроксоди-хромат Сr(ОН)Сr2О7 x2Н2О, осаждающийся из водных р-ров. Это коричневое аморфное в-во, раств. в разб. к-тах и щелочах; при 100-160 °С обезвоживается, при 250-350 °С разлагается.
Оксид Сr3О8 [или Сr2(Сr2О7)2(Сr3О10) - очень мелкие темно-коричневые кристаллы; антиферромагнетик, т-ра Нееля ~ 80 К; быстро разлагается водой; получают разложением СrО3 на воздухе (270-300 °С), в атмосфере О2 (240 °С) или гидротермальным его разложением (270 С). Оксид Сr2О5 и Сr3О8 рекомендованы как материалы катодов литиевых источников тока.
Декахромат хрома Сr2(Сr10О31)3, или СrО2,906 , является первичным продуктом термич. разложения СrО3. Черный аморфный порошок с плотн. 2,88 г/см3; разлагается, начиная с 240 °С, с образованием СrО3 и Сr3О8.
Триоксид хрома (хромовый ангидрид) СrО3 - красные или фиолетово-красные кристаллы; при давлении 11,5 ГПа и т-ре 23 °С переходит в др. модификацию; т. пл. 180-202 °С (в зависимости от степени разложения); заметно испаряется с диссоциацией в парах, ур-ние температурной зависимости давления пара lgp (мм рт. ст.) = 20,14 - 10300/T (448 - 468 К); полупроводник. Малоустойчив, начинает разлагаться уже при комнатной т-ре. При медленном нагревании при 210-270 °С образуется Сr3О8, при 270-300 °С - Сr5О12, при 360-540 °С - СrО2. Очень сильный окислитель. Гигроскопичен, расплывается на воздухе. Хорошо раств. в воде с образованием хромовых к-т, существующих только в водных р-рах; р-римость 62,49% по массе при 20 °С, 65,79% при 80 °С. Ниже 102 °С кристаллизуется гидрат СrО3 x 3,5Н2О.
Между хромовой Н2СrО4 и дихромовой Н2Сr2О7 к-тами в р-ре устанавливается равновесие, при разбавлении р-ра оно сдвигается в сторону образования хромовой к-ты. Обе эти к-ты сильные, они полностью диссоциированы по первой ступени, но по второй ступени, напротив, диссоциируют в незначит. степени. В конц. сильнокислых р-рах СrО3 образуются также ионы трихромовой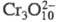 итетрахромовой
итетрахромовой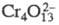 к-т.
к-т.
При действии на р-ры СrО3 серы, В, С и нек-рых металлов (Mg, Zn, Сu, Сr, Мо и др.) при нагр. происходит полимеризация с получением хромовых полимеров - от вязкотекучих до смолоподобных и стекловидных. Полимеры рентгеноаморфны, мол. м. 103 - 104. Ионы металлов входят в состав полимера, тогда как неметаллы большей частью оказывают только каталитич. действие. Смолы обратимо раств. в воде. Полимеры, помимо Cr(VI), содержат также Сr(IIi), Cr(IV) и Cr(V).
Триоксид Сr и хромовые к-ты вызывают тяжелые ожоги кожи, дерматит, язвы. Могут вызывать желтуху, бронхиальную астму, язву желудка, поражения почек. ПДК хрома оксидов в атм. воздухе 0,01 мг/м3.
Известны соед. с содержанием кислорода больше, чем в СrO3: пероксиды, представителямик-рыхявляются синие перхромат Cr2(CF2O10)3 и гидропероксид СrО(О2)2 x Н2О.
П. И. Федоров.
