Германаты
ГЕРМАНАТЫ, соли не полученных в своб. состоянии кислородных к-т Ge(IV): метагерманиевой H2GeO3, ортогерманиевой H4GeO4, дигерманиевой H2Ge2O5, тетрагерма-ниевой H2Ge4O9, пентагерманиевой H2Ge5On, нонагерма-ниевой H4Ge9O20 и др. наиб. распространены орто-и метагерманаты.Германаты с координац. числом германия 4, как правило, изоморфны соответствующим силикатам. В основе структуры ортогерманатов лежат тетраэдры GeO4, метагерманатов— шестичленные кольца Ge3O9 или тетраэдры, объединенные в цепи. Германаты с координац. числом германия 6 построены из октаэдров GeO6. Структура соед., в к-рых Ge имеет координац. числа как 6, так и 4, включает сочлененные общими вершинами или ребрами октаэдры и тетраэдры.
Наиб. изучены германаты металлов в степени окисления + 1 и + 2. Щелочные металлы и Ag(I) образуют мета-, орто-, тетра-, нонагерманаты и др. Для Na и К известны также дигидрогерманаты K2H2Ge4O10 и Na2H2GeO4*6H2O. Щелочные металлы, Ag(I), T1(I) и аммоний образуют германиевые цеолиты M3HGe7O16*4H2O. В цеолитах (устойчивы до 800 °С) присутствуют атомы германия с координац. числами 4 и 6. Для Na и К получены также пероксо-германаты M2GeO3*2H2O2*2Н2О и M2Ge2O5*2H2O2 *Н2О.
Металлы в степени окисления + 2 образуют орто-, мета-, ди- и тетрагерманаты. Известны также германаты составов: 3MO*GeO2, где М-Са, Ва, Zn, Pb; 2MO*3GeO2, где М-Са, Pb; 6PbO*GeO2, 5PbO*3GeO2, PbO-3GeO2 и 4MgO*GeO2. Из холодных р-ров солей М(II) и GeO2 (или Na2GeO3) осаждаются гидратированные аморфные осадки состава mМО*GeO2*хН2О, где m = 1,2 или 3, из горячих рров - кристаллич, гидрогерманаты, напр. BaH2GeO4*4H2O и SrH2GeO4. Магний и никель образуют германаты типа серпентина M3Ge2O5(OH)4 и талька M3Ge4OXo(OH),.
Для мн. металлов в степени окисления + 2 наиб. устойчивы ортогерманаты, образующиеся при нагр. других германатов. Для них, а также для метагерманатов характерен полиморфизм.
Элементы в степени окисления + 3 образуют ортогерманаты и германаты составов M2GeO5, М2Gе2О7, La2O(GeO4), La2(GeO3)3, 6Bi2O3*GeO2 Fe2O3*4GeO2 (т. пл. 1200°C), 2Fe2O3*3GeO2 (т. пл. 1335°C с разл.). Метагерманат La устойчив до т-ры плавления (1600°С), выше к-рой разлагается на пирогерманат La и GeO2, Германаты остальных РЗЭ более тугоплавки (т. пл, > 1730°С). Из водных р-ров GeO2 и М(ОН)3 осаждаются аморфные гидратированные германаты, в к-рых соотношение М2О3:GeO, составляет 1 :1 или 1 :2 (М-А1, Fe), 1:3 (Fe), 1,5:1 (Al), 3:1 (La).
Элементы в степени окисления + 4 образуют ортогерманаты, a Zr и Hf- также соед. M3GeO8,
Получены германаты, содержащие в молекуле неск. хим. элементов, отличающихся степенью окисления; их структура аналогична структуре соответствующих силикатов-полевых щпатов, сподумена, монтмориллонита, пермутита и др. наиб. практич. значение имеют германиевые гранаты A3B2Ge3O12, где А-Са, Mg, Zn, Fe и др., В-А1, Mb, Ga, Sn, РЗЭ и др. Гранаты обладают св-вами диэлектриков; их используют в электронио-вычислит. устройствах, магн. интегральных схемах (в осн. в кач-ве подложек).
Из GeO2 и оксидов металлов получают германиевые стекла. Для стекол на основе оксидов Ва, Ti и Pb nD20 от 1,86 до 1,99 при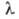 6 мкм, для германиево-фосфатно-титановых-коэф. пропускания ок. 80% при
6 мкм, для германиево-фосфатно-титановых-коэф. пропускания ок. 80% при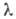 0,5-0,7 мкм, Стекла на основе GeO2, PbO, ZnO2, A12O3 (или La2O3) сильно поглощают рентгеновское излучение. Германиевые стекла используют для изготовления призм, кювет, окошек, фильтров в оптич. приборах, электродов, терморезисторов, для защиты от рентгеновского излучения.
0,5-0,7 мкм, Стекла на основе GeO2, PbO, ZnO2, A12O3 (или La2O3) сильно поглощают рентгеновское излучение. Германиевые стекла используют для изготовления призм, кювет, окошек, фильтров в оптич. приборах, электродов, терморезисторов, для защиты от рентгеновского излучения.
Германаты щелочных металлов существенно лучше раств. в воде, чем остальные. Для соединений щел.-зем. металлов р-римость тем выше, чем больше ат. масса металла (р-римость Mg2GeO4 ~ 0,016 г/л). Германаты РЗЭ практически не раств. в воде и 0,1 н. р-ре NaOH. Минер, к-тами все германаты, как правило, разлагаются. Гидрогерманаты, а также гидраты германатов при нагр. отщепляют воду с образованием безводных солей.
Общий метод получения безводных германатов-спекание (реже сплавление) смеси GeO2 с соответствующим оксидом или карбонатом металла. Процесс ускоряется при замене 3-5% оксида или карбоната металла на его фторид. Гидраты германатов и гидрогерманаты получают: осаждением из водных р-ров, содержащих GeO2 или германата щелочного металла и соли соответствующего элемента; гидролизом безводных германатов; гидротермальным синтезом.
Наиб. важные германаты описаны ниже.
Германат свинца Pb5Ge3O11-белые кристаллы, гексагон. решетка (а = 1,0251 нм, с = 1,0685 нм); т. пл, 740 °С; не раств. в воде и органических растворителях. Получают сплавлением GeO2 с РbСО3. Используют как материал для детекторов в ИК-спектрометрах, акусто- и оптоэлектронных приборах.
Германат висмута Bil2GeO20 (германосилленит)-белые кристаллы, кубич. решетка (а = 1,0145 нм); т. пл. 923 °С; не раств. в воде; сегнетоэлектрик. Получают сплавлением GeO2 с Bi2O3. Используют как материал для модуляторов света, звукопроводов в акустоэлектронных устройствах.
Метагерманат натрия Na2GeO3-белые кристаллы, ромбич. решетка (а = 0,622 нм, b= 1,087 нм, с = 0,492 нм, z=4); т. пл. Ш60°С; плотн. 331 г/см3; раств. в воде; гигроскопичен; обладает сильным двойным лучепреломлением. Получают еплавлением Na2O с GeO2, Используют для синтеза др. соед. Ge.
Гидрогерманат натрия Na3H2GeO4*6H2O-белые кристаллы, ромбич, решетка (а= 0,652 нм, b = 1,737 нм, с = 0,847 нм); т. пл. 85°С; плотн. 2,05 г/см3; раств. в воде (259 г/л при 25oС); поглощает из воздуха СО2; слабо гигроскопичен. Получают выпариванием водного р-ра Na2GeO3, содержащего NaOH. Используют для синтеза др. соед. Ge, в частности его гидролизом получают цеолит Na3HGe7O16*4H2O, к-рый применяют как катализатор поликондснсации этилентерефталата.
Германат магния Mg4GeO6-белые кристаллы, гексагон. рещетка (а - 1,1773 нм, с = 1,4448 нм); при ~ 1500°С диссоциирует на Mg2GeO4 и MgO; показатели преломления: 1,740 (для обыкновенного луча) и 1,755 (для необыкновенного). Получают спеканием при 1150°С стехиометрич. кол-в GeO2 с MgO (или MgCO3). Используют как компонент фосфбров,
Германаты типа 2BaO*MO*2GeO2*xPbO (M-Mg, Zn)-компоненты люминофоров. Используются, напр., для цветной печати.
Лит. см. примет. Германий. М. Я. Шпирт.
