§ 6. Подгруппа марганца
Из элементов данной подгруппы № 43 – технеций (Тс) – в земной коре не содержится. Очень малые его количества были получены искусственно, причем установлено, что по химическим свойствам он в общем гораздо ближе к рению, чем к марганцу. Однако детальное изучение самого элемента и его соединений пока не осуществлено.
Марганец принадлежит к распространенным элементам, составляя 0,03% от общего числа атомов земной коры. Небольшие количества Мn содержат многие горные породы. Вместе с тем встречаются и скопления его кислородных соединений, главным образом в виде минерала пиролюзита – МnО2 ·xН2 О. Ежегодная мировая добыча марганцовых руд составляет около 5 млн. т.
Чистый марганец может быть получен электролизом растворов его солей. Однако 90% всей добычи Мn потребляется при изготовлении различных сплавов на основе железа. Поэтому из руд обычно выплавляют прямо его высокопроцентный сплав с железом – ферромарганец (60–90% Мn), которым затем и пользуются для введения марганца в другие сплавы. Выплавку ферромарганца из смеси марганцовых и железных руд ведут в электрических печах, причем марганец восстанавливается углеродом по реакции:
МnО2 + 2С + 70 ккал = 2СО + Мn
Содержание рения в земной коре весьма мало (9 ·10–9 %). Элемент этот является чрезвычайно распыленным: даже наиболее богатые рением минералы (молибдениты) содержат его в количествах, обычно не превышающих 0,002% по весу. Сколько–нибудь широкого использования рений и его производные пока не находят.
1) Для получения металлического рения обычно пользуются нагреванием перрената аммония в токе водорода:
2NH4 ReO4 +4H2 = 8H2 O + N2 + 2Re
Ежегодная мировая выработка рения и его производных исчисляется сотнями килограммов.
В виде порошков марганец и рений представляют собой серые, в компактном состоянии – белые металлы, похожие по внешнему виду на железо (Мn) или платину (Re). Важнейшие их константы сопоставлены ниже:

Механические свойства обоих металлов сильно зависят от способа их выделения и предварительной обработки.
2) Электропроводность рения приблизительно в 4 раза меньше, чем вольфрама. Металл этот представляет собой прекрасный материал для изготовления нитей электроламп, более прочных и долговечных, чем обычные вольфрамовые.
На воздухе компактный металлический марганец покрывается тончайшей пленкой окисла, которая предохраняет его от дальнейшего окисления даже при нагревании. Напротив, в мелко раздробленном состоянии он окисляется довольно легко. Взаимодействие его с галоидами протекает весьма энергично и ведет к образованию солей МnГ2 . При нагревании марганец соединяется также с другими типичными металлоидами – серой, азотом, фосфором, углеродом, кремнием и бором. С водородом он не реагирует.
Химическая активность рения несколько ниже. Так, он взаимодействует при нагревании с кислородом, серой и галоидами, но с азотом непосредственно не соединяется. Водород довольно сильно поглощается порошком рения, однако каких–либо химических соединений при этом не образуется.
В ряду напряжений марганец стоит между Mg и Zn. В соответствии с этим порошок его при нагревании разлагает воду, С разбавленными кислотами марганец реагирует весьма энергично, вытесняя водород по реакции, например:
Mn + H2 SO4 = >MnSO4 + H2
Рений располагается в ряду напряжений несколько правее меди и с разбавленными НСl и H2 SO4 не взаимодействует. Азотная кислота реагирует с ним по уравнению:
3Re + 7HNO3 = >3HReO4 + 7NO + 2Н2 О
Положение технеция в ряду напряжений пока не установлено. Известно, однако, что он вытесняется из растворов его солей цинком и может быть осажден на катоде при помощи, электролиза.
Марганец весьма интересен в химическом отношении, так как образует соединения, на которых может быть прослежено влияние изменения валентности элемента на свойства. Хорошо изучены его производные, отвечающие следующим окислам:
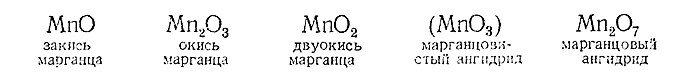
Так как повышение положительной валентности атома связано с увеличением его заряда и уменьшением радиуса, можно ожидать (в соответствии с рис. 87) что диссоциация марганцовых соединений типа ЭОН будет при разных валентных состояниях марганца протекать различно. Как показывает приводимая ниже схема, это и имеет место в действительности:
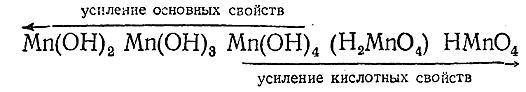
Аналогичное изменение свойств наблюдается у производных рения. И для Re и для Тс наиболее характерно семивалентное состояние.
Обычным исходным продуктом для получения соединений марганца служит природный пиролюзит. Нагреванием его в струе водорода может быть получен зеленый, нерастворимый в воде, но легко растворяющийся в кислотах порошок закиси марганца (МnО). Отвечающие этому окислу соли образуются также при растворении в кислотах самого пиролюзита, например, по реакциям:
МnО2 + 4НСl = МnСl2 + Сl2 + 2Н2 О
2MnO2 + 2H2 SO4 = 2MnSO4 + O2 + 2H2 O
При действии на растворы этих солей щелочами в осадок выпадает белый гидрат закиси марганца [Мn(ОН)2 ]. На воздухе он постепенно буреет вследствие окисления по схеме:
2Мn(ОН)2 + О2 + 2Н2 О = 2Мn(ОН)4
Практически нерастворимый в воде Мn(ОН)2 является основанием и при взаимодействии с кислотами дает соответствующие соли двухвалентного марганца. Большинство последних имеет розовый цвет (иона Мn··) и хорошо растворимо в воде. Соли двухвалентного марганца являются наиболее устойчивыми производными этого элемента в кислой среде.
Черная окись марганца (Мn2 Оз) может быть получена нагреванием пиролюзита до 800 °С.
Соответствующий ей черно–коричневый гидрат Мn(ОН)3 почти нерастворим в воде и является очень слабым основанием. Соли его, как правило, неустойчивы и с ними в практике встречаться не приходится.
В то время как МnO2 является наиболее устойчивым при обычных условиях кислородным соединением марганца, ReO2 может быть получена лишь исходя из высшего окисла рения (Re2 O7 ) и при нагревании на воздухе или под действием окислителей легко переходит в него обратно. Обе двуокиси представляют собой черные нерастворимые в воде вещества. Практически нерастворимы и отвечающие им темно–бурые гидроокиси Э(ОН)4 , характеризующиеся амфотерными свойствами. Однако и основная и кислотная функции обеих гидроокисей выражены крайне слабо. Производящиеся от них соли, как правило, малоустойчивы.
3) Соли, отвечающие кислотной функции гидрата двуокиси марганца, носят название марганцоватистокислых или манганитов. Выделить их в чистом состоянии весьма трудно.
Из солей, отвечающих основной функции Мn(ОН)4 , известен черный сульфат Mn(SO4 )2 . Он растворим в крепкой серной кислоте, но при разбавлении раствора водой полностью гидролизуется.
4) От марганцоватистой кислоты (и гидрата закиси марганца как основания) производится встречающийся в природе темно–красный минерал гаусманит:
2Мn(OН)2+Н4 МnO4 = > Мn2 МnO4 +4Н2 O
Таким образом, с химической точки зрения гаусманит (МnзО4 ) является марганцоватистокисдым марганцем.
При сплавлении МnО2 со щелочью в присутствии окислителей образуется соответствующая соль марганцовистой кислоты (Н2 МnО4 ), в которой марганец шестивалентен. Обычно тонко размолотый пиролюзит смешивают с 50%–ным раствором КОН и окисление проводят при 250 °С за счет кислорода воздуха:
2МnО2 + 4КОН + О2 = 2К2 МnO4 + 2Н2 О
Соли Н2 МnO4 (марганцовистокислые, или манганаты) окрашены в темно–зеленый цвет.
Манганаты Na и К хорошо растворимы в воде, манганат Ва малорастворим.
Выделяющаяся при подкислении растворов манганатов свободная Н2 МnО4 неустойчива и тотчас распадается по схеме:
ЗН2 МnO4 = МnО2 + 2НМnО4 + 2Н2 О
с образованием МnО2 и свободной марганцовой кислоты (НМnО4 ). Аналогичный самопроизвольный распад, например, по схеме
ЗК2 МnO4 + 2Н2 О = МnО2 + 2КМnО4 + 4КОН
характерен в растворах и для манганатов, но протекает он лишь по мере их гидролиза, т. е. значительно медленнее.
Все производные, шестивалентного марганца являются сильными окислителями и легко восстанавливаются до МnО2 (в щелочной среде) или соответствующих солей Мn2+ (в кислой). С другой стороны, действием очень сильных окислителей (например, свободного хлора) манганаты могут быть окислены до соответствующих солей марганцовой кислоты:
2К2 МnO4 + Сl2 = 2КСl + 2КМnО4
Приведенная реакция иногда используется для получения КМnО4 . Соль эта (т. н. перманганат) является одним из наиболее практически важных соединений марганца.
Окислы семивалентных элементов очень сильно отличаются друг от друга по устойчивости. Желтый рениевый ангидрид (Re2 O7 ) может быть легко получен нагреванием порошка рения на воздухе. При 297 ºС он плавится и при 363 °С кипит без разложения. Последнее начинает становиться заметным лишь около 600 °С.
Марганцовый ангидрид (Мn2 О7 ) выделяется в виде зеленовато–черной маслянистой жидкости при действии холодной 90%–ной H2 SO4 на измельченный КМnО4 . Он устойчив лишь ниже 0°С и уже при обычных температурах способен распадаться со взрывом на МnО2 и кислород (содержащий значительную примесь озона). В противоположность Re2 O7 марганцовый ангидрид обладает чрезвычайно сильными окислительными свойствами. Так, эфир и спирт при соприкосновении с ним воспламеняются.
При взаимодействии ангидридов Э2 О7 с водой образуется соответственно бесцветный раствор рениевой (HReO4 ) или фиолетово–красный раствор марганцовой кислоты. Первый из них может быть без разложения кислоты упарен досуха. Второй выдерживает сгущение лишь до 20%–ного содержания НМnО4 , после чего начинается ее распад по уравнению:
4НМnО4 = 4МnО2 + ЗО2 + 2Н2 О
Марганцовая кислота является очень сильной и диссоциирована примерно в такой же степени, как НСl и HNO3 . Рениевая кислота диссоциирована несколько слабее.
Соли марганцовой кислоты (марганцовокислые, или перманганаты) окрашены, как правило, в фиолетово–красный цвет иона МnO4 , соли рениевой (рениевокислые, или перренаты), подобно самому иону ReO бесцветны. Для обеих кислот (как и для сходной с ними по структуре хлорной) характерно образование малорастворимых солей с катионами Rb+и Cs+.
По отношению к нагреванию перренаты весьма устойчивы, Например, KReO4 при 1370 °С перегоняется без разложения. Напротив, КМnО4 уже выше 200 °С распадается, в основном по схеме:
2КМnО4 = > К2 Мn04 + МnО2 + О2
Реакция эта пригодна для лабораторного получения кислорода.
Окислительные свойства, резко выраженныеу марганцовой кислоты и ее солей, для рениевой кислоты к перренатов нехарактерны и переход их в производные низших валентностей рения происходит лишь под воздействием очень сильных восстановителей. Технеций занимает промежуточное положение: образующая розовый раствор НТсО4 может быть восстановлена довольно легко.
Из солей НМnО4 особенно часто приходится иметь дело с калийной – КМnО4 , представляющей собой темно фиолетовые кристаллы.
В технике ее обычно получают электролизом крепкого раствора К2 MnO4 : у анода при этом образуется КМnО4 (по схеме: MnO4 ’’ – e– = > MnO4 ), а на катоде выделяется водород.
Марганцовокислый калий является очень сильным окислителем и в кислой и в щелочной среде. Например, железный купорос окисляется им по уравнениям:
2KMnO4 + 10FeSO4 + 8H2 SO4 = K2 SO4 + 2MnSO4 + 5Fe2 (SO4 )3 + 8H2 O
KMnO4 + 3FeSO4 + 5KOH + 2H2 O = 3K2 SO4 + MnO2 + 3Fe(OH)3
Характер восстановления перманганата в кислой (до Мn··) и в щелочной или нейтральной среде (до МnО2 ) следует запомнить, так как с окислением различных веществ при его помощи часто приходится встречаться в химической практике.
5) Ход восстановления КМnО4 в растворе существенно зависит от реакции среды. Примером может служить окисление сернистокислого калия:
в кислой среде: 5K2 SO3 +2КМnО4 + 3H2 SO4 = >6K2 SO4 + 2MnSO4 + ЗН2 О
в нейтральной среде: 3K2 SO3 + 2КМnО4 + Н2 О = >3K2 SO4 + 2MnO2 + 2KOH
в щелочной среде: K2 SO3 + 2КМnО4 + 2КОН = >K2 SO4 + 2K2 MnO4 + Н2 О
Однако процесс по последнему уравнению осуществляется лишь при определенных условиях – недостатке восстановителя и большой концентрации щелочи. Вместе с тем он приводит систему только к метастабильному состоянию: хотя избыточная щелочь более или менее задерживает гидролиз образующегося ман–ганата., но в конце концов гидролиз этот и связанный с ним распад по схеме:
3MnVI = > MnIV + 2MnVII
проходят до конца. Поэтому устойчивым конечным продуктом восстановления КМnО4 в щелочной среде, как и в нейтральной, является МnО2 .
6) Щелочным раствором КМnО4 удобно пользоваться для очистки лабораторной посуды от органических веществ. Выделяющуюся на стенках МnО2 удаляют затем промыванием сосуда крепкой соляной кислотой.
Перманганат находит применение и в медицине. Например, при ожогах рекомендуется сразу смочить обожженное место 4%–ным раствором КМnО4 – при этом кожа подсушивается и пузырь не образуется.
7) Помимо приводившихся выше, для химии марганца весьма характерна легко протекающая реакция образования средней степени окисления из низшей и высшей: 3MnSO4 +2KMnO4 +2H2 O = 5MnO2+K2 SO4 +2H2 SO4 . Реакция эта в принципе обратна распаду К2 МnО4 на МnО2 и КМnО4 .
Если теперь, после рассмотрения химии галоидов и элементов подгруппы марганца, сопоставить их соединения, то бросается в глаза резкое различие свойств в низших валентнстях и большое сходство в высших. Как и следовало ожидать с точки зрения учения об электронных аналогах, при своей высшей валентности элементы подгруппы марганца являются аналогами хлора. Действительно, Re2 O7 и Мn2 О7 аналогичны Cl2 O7 , рениевая и марганцовая кислоты – хлорной, тогда как соответствующие производные семивалентного брома неизвестны.


