Асимметрический синтез
Как уже было указано выше, при синтезе соединений с асимметрическим атомом углерода из оптически недеятельных молекул одинаково вероятно образование обеих оптически противоположных конфигураций. Наоборот, если новый асимметрический атом углерода появляется в оптически деятельном веществе, то отношения двух антиподных конфигураций нового асимметрического атома (abc и acb на рис. 38) к ранее имевшейся системе асимметрического атома (xyz) будут неодинаковы. Поэтому вероятности образования конфигураций I и II также должны быть неодинаковы. Если затем удалить из молекулы первоначальную оптически деятельную систему хуz, то получится, как правило, смесь неравных количеств обоих стереоизомеров. Действительно, Марквальду и Маккензи удалось осуществить такой синтез оптически деятельного вещества, названный асимметрическим синтезом. Так, например, соль оптически деятельного алкалоида бруцина с метилэтилмалоно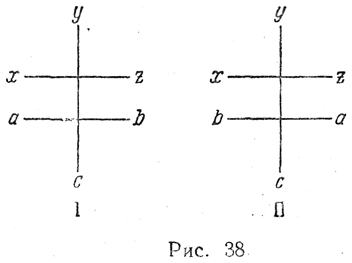 вой кислотой при нагревании отщепляет двуокись углерода и образует соль метилэтилуксусной кислоты, обладающую слабым левым вращением:
вой кислотой при нагревании отщепляет двуокись углерода и образует соль метилэтилуксусной кислоты, обладающую слабым левым вращением:
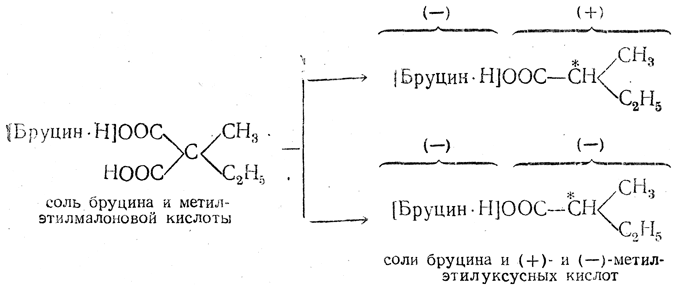
Как видно из приведенной схемы, соли правой и левой метилэтилуксусных кислот не являются оптическими антиподами, и потому образование этих двух солей должно происходить с неодинаковой легкостью.
Аналогичным образом, при восстановлении сложного эфира пировиноградной кислоты и оптически деятельного спирта борнеола
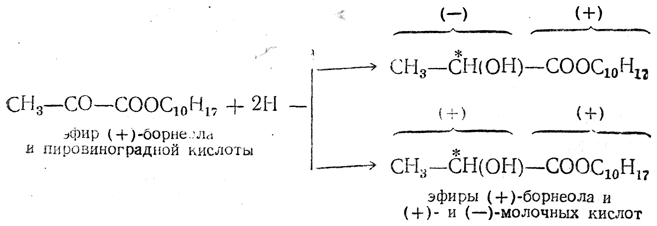
вероятность образования эфиров правой и левой молочных кислот неодинакова. Поэтому, после удаления остатка (+)-борнеола омылением, получается молочная кислота, обладающая левым вращением.
В указанных примерах оптически деятельные остатки бруцина и (+)-борнеола играют роль вспомогательной системы xyz, благодаря влиянию которой системы abc и acb образуются в неравных количествах.
Если при действии металлоорганических соединений на оптически деятельные вещества с карбонильной группой, расположенной рядом с асимметрическим атомом углерода
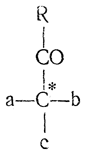
возникает второй асимметрический атом углерода, то из двух могущих образоваться стереоизомерных спиртов I и II
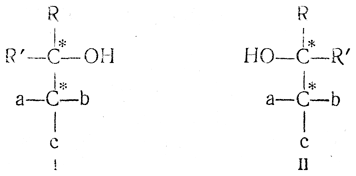
образуется только один.
Чем большим числом атомов углерода отделена карбонильная группа от асимметрического атома углерода в исходных соединениях типа
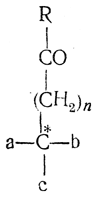
тем в большем количестве образуется также и второй стереоизомер. Это объясняет, почему в осуществленных до сих пор асимметрических синтезах, при которых оптически деятельный асимметрический атом углерода исходного соединения был очень значительно отделен от вновь образующегося асимметрического атома, получались вещества лишь со слабым оптическим вращением.
Таким образом, мы видим, что все перечисленные способы получения оптически деятельных веществ связаны с прямым или косвенным участием биологических процессов. Действительно, в первом способе Пастера для расщепления на антиподы требуется непосредственная жизнедеятельность микроорганизмов, во втором (а также в асимметрических синтезах) — исходными веществами являются оптически деятельные соединения, например алкалоиды, а при третьем способе отбор кристаллов сознательно производится человеком. Между тем вещества с асимметрическими атомами углерода, образующиеся при биологических процессах в животных организмах и в растениях, почти всегда получаются исключительно или по крайней мере преимущественно в виде одного из оптических антиподов. Если образование оптически деятельных антиподов при помощи оптически деятельных белков или хлорофилла может быть объяснено асимметрическим синтезом, то первоначальное возникновение в организмах оптически деятельных веществ очень долго не удавалось объяснить обычными химическими реакциями.
Пастер полагал, что в биологических процессах, приводящих к образованию оптически деятельных веществ, проявляются какие-то особые «асимметрические силы», действие которых подобно действию человека при отборе правых кристаллов от левых. Такого рода взгляды представляли последнее прибежище виталистического мировоззрения в области органической химии.
В настоящее время представление о существовании «асимметрических сил» окончательно опровергнуто экспериментально. Правда, попытки осуществить асимметрический синтез, проводя химические реакции в сильных магнитных полях (поскольку асимметричное поле земного магнетизма привлекалось для объяснения преимущественного возникновения одного из оптических антиподов), оказались неудачными. Однако асимметрический синтез под влиянием сил неживой природы удалось осуществить другим путем.
После того как опытами Коттона (1896) было показано, что растворы оптических изомеров в неодинаковой степени поглощают лучи света, обладающие противоположной по направлению круговой поляризацией, чехословацкий ученый Бык (1904 — 1909) высказал предположение о возможности осуществления асимметрического синтеза при использовании для проведения фотохимических реакций световых лучей, поляризованных по кругу. В. Кун и Браун (1929), проводя разложение этилового эфира α-бромпропионовой кислоты при облучении светом с правой или левой круговой поляризацией, получили вещества с небольшой, но вполне определенной оптической активностью ([α]D=±0,05°). В дальнейшем этот прием асимметрического синтеза был подтвержден работами ряда других авторов. Особенно интересным оказался пример синтеза правовращающей винной кислоты прямым гидроксилированием эфира фумаровой кислоты перекисью водорода (Тенни, Аккерман, 1945):
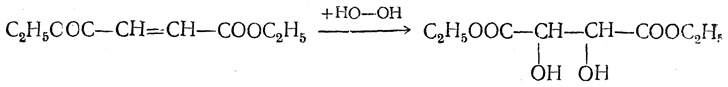
Этим путем были получены препараты с удельным вращением + 0,073° (при освещении лучами с правой круговой поляризацией).
Новым приемом асимметрического синтеза было предложение проводить каталитические реакции, применяя катализаторы, наносимые на поверхности правой или левой модификаций кристаллов кварца (Шваб, 1932—1934). Оказалось, что при дегидрогенизации рацемического 2-бутанола над Ni на кварце реагирует главным образом левый изомер. Из продуктов реакции удалось выделить 2-бутанол с [α]d до +0,13°. А. П. Терентьев (1950) успешно расширил и распространил этот прием и на собственно синтетические процессы; например, конденсацией под действием следов щелочи, нанесенной на порошок из правых кристаллов кварца, ему удалось из метилциклогексанона и нитрила акриловой кислоты при комнатной температуре получить продукт с [α]D до +0,157°.


