Тиокислоты
Тиокислоты (от тио...), сернистые аналоги кислородных кислот, в молекулах которых кислород замещен на серу.
Неорганические тиокислоты нестойки и в свободном состоянии их выделить обычно не удаётся; однако соли таких тиокислот (тиосоли), например Na2S2O3, эфиры, например As (SC6H5)3, и ангидриды, например Sb2S3, — достаточно прочные вещества.
Органические тиокислоты (тиокарбоновые кислоты) подразделяются на монотиокарбоновые — тиоловые (а) и тионовые (б), дитиокарбоновые (в) кислоты:
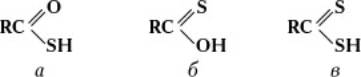
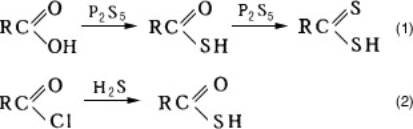
Монотиокарбоновые кислоты существуют в виде таутомерной смеси с сильным преобладанием тиоловой формы; производные известны для обеих форм. Тиокислоты (особенно простейшие) обладают сильным неприятным запахом. По сравнению с соответствующими карбоновыми кислотами, тиокислоты — более сильные кислоты, в воде растворяются хуже, кипят при более низких температурах. Органические тиокислоты получают главным образом взаимодействием карбоновых кислот с пятисернистым фосфором (1) или производных карбоновых кислот с сероводородом (2):
Амиды тионовых кислот (тиоамиды) RC (S) NR¢2 применяются в синтезах гетероциклических соединений; амид a-этилизотионикотиновой кислоты (этионамид) — противотуберкулёзное средство. Эфиры дитиоугольной кислоты (ксантогенаты) используются в производстве вискозного волокна (см. Вискоза), а также в качестве гербицидов.
Б. Л. Дяткин.
