Тиокарбонильные соединения
ТИОКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ, орг. соед., содержащие тиокарбонильную группу В статье рассмотрены тиоальдегиды RCH=S и 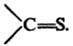 тиокетоны RR'C=S. О других тиокарбонильных соединениях см. Дитиокарбоновые кислоты, Тиокарбоновые кислоты, Тиоугольные кислоты.
тиокетоны RR'C=S. О других тиокарбонильных соединениях см. Дитиокарбоновые кислоты, Тиокарбоновые кислоты, Тиоугольные кислоты.
Тиоальдегиды и тиокетоны называют аналогично соответствующим альдегидам и жетонам, используя суффиксы "тиаль" (или "карботиальдегид") и "тион", напр.: CH3CH2CH2CHS называют бутантиаль; в полифункцион. соединениях используют префиксы "тиоформил" и "тиоксо" (или "тионо"), напр.: SСНС6Н4СООН называют тиофор-милбензойная к-та, CH3C(S)CH2CH2C6H4COOH называют (3-тиоксобутил)бензойная к-та, назв. нек-рых тиокарбонильных соединений производят от назв. их кислородных аналогов с префиксом "тио", напр, тиоформальдегид HCHS, тиоацетон CH3C(S)CH3.
Алифатические тиокарбонильные соединения в виде мономеров существуют только в газовой фазе при низком давлении (время жизни от неск. минут до неск. недель); при нормальных условиях образуют бесцв. циклодимеры (1,3-дитиетаны), циклотримеры (1,3,5-тритианы) и линейные полимерыдля многих из к-рых возможна термич. деполимеризация.
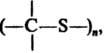
Алифатические тиокарбонильные соединения окрашены в цвета от желтого до темно-синего и обладают чесночным запахом. b-Функциональные a,b-не-насыщ. ароматические и гетероциклические тиокарбонильные соединения имеют более глубокую окраску, слабый "овощной" запах; как правило, термодинамически устойчивы.
В тиокарбонильных соединениях длина связи C=S ок. 0,16 нм, ее полярность ниже, а поляризуемость выше, чем у связи С=О. В ИК спектрах тиокарбонильных соединений присутствуют неск. полос поглощения в области 950-1270 см-1. Электронные спектры содержат, как правило, три области поглощения в интервалах 500-700, 250-300 и 210-240 нм, соответствующие n:p*-, p:p*- и n:s*-переходам. В спектрах ПМР хим. сдвиг (d) 9-13 м.д. (CH=S) и находится в более слабом поле, чем у соответствующих альдегидов. Для мн. пар тиокарбонильных соединений и их кислородных аналогов установлена корреляция между хим. сдвигами в спектрах ЯМР 13С: d(C=S) = 1,46d(С=O) - 49,4 (м.д.).
Строение тиокарбонильных соединений может быть представлено резонансом структур, что обусловливает их хим. св-ва:

Тиокарбонильные соединения легко присоединяют по тиокарбонильной группе ну-клеофилы: воду, спирты, амины и др., образуя чаще всего гем-бифункцион. аддукты; при возможности дальнейшего отщепления H2S образуются те же продукты (имины и их замещенные, азометины и др.), что и из соответствующих карбонильных соед., напр.:
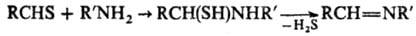
Металлоорг. нуклеофилы присоединяются к алифатическим тиокарбонильным соединениям как по атому С, так и по атому S, а к ароматическим тиокарбонильным соединениям и перфтортиоацетону, как правило, только по атому S, напр.:
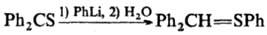
Взаимод. диарилтиокетонов с избытком реактива Гриньяра приводит к тииранам, напр.:
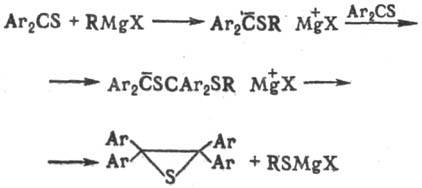
Ароматические тиокарбонильные соединения, будучи сильными акцепторами электронов, образуют со щелочными металлами последовательно малоактивный анион-радикальный и далее дианионный комплекс, имеющий важное препаративное значение, напр.:
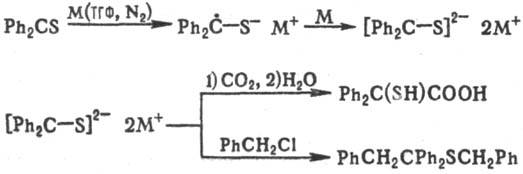
Р-ции с электрофилами особенно характерны для тиокарбонильных соединений, способных образовывать ентиольную таутомерную форму, напр.:
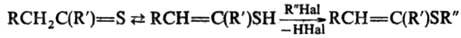
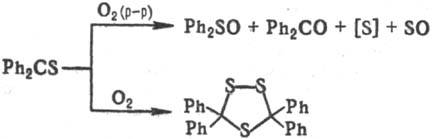
Окисление тиокарбонильных соединений О2 в зависимости от условий протекает по разным направлениям:
Восстановление тиокарбонильных соединений приводит к тиолам и(или) углеводородам.
Большинство тиокарбонильных соединений вступает в диеновый синтез в качестве диенофилов; с диазосоед. образуют, в зависимости от природы реагентов, тиираны или 1,3-дитиоланы.
Специфич. р-ция тиокарбонильных соединений (в отличие от карбонильных соед.) - образование олефинов при натр. в присут. металлов (Zn, Cu, Fe):
2Ar2CS + 2Zn : Аr2С=САr2 + 2ZnS
Общие методы синтеза тиокарбонильных соединений.
1) Тионирование карбонильных соед. и их азааналогов под действием разл. осерняющих реагентов: H2S, P4S10, CS2, S2Cl2, S8, (R2NS)2, RCOSH, Na2S2O3, а также соед. ф-лы I
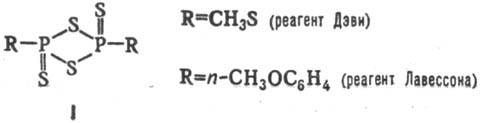
Р-цию проводят в тщательно подобранных условиях во избежание побочных р-ций (восстановления, гетероциклиза-ции, глубокого осернения).
2) Р-ции енаминов, эфиров, енолов, алкенилгалогенидов с H2S, NaSH, Na2S, Na2S2O3.
3) Взаимод. алкил- или аралкилхлоридов и гем-дигало-генидов с S-нуклеофилами, напр.:
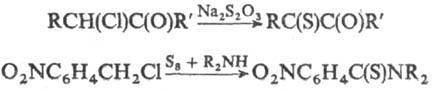
Для получения ароматических и гетероциклических тиокарбонильных соединений используют NaSH, CH3COSH, тиомочевину, SiS2 и др.
4) Присоединение H2S, CS2 и др. к ацетиленам, напр.:
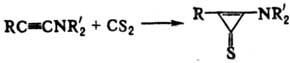
5) Термолиз гем-дитиолов, сульфидов, S-гетероциклов, напр.: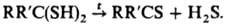
6) Фотохим. превращения серосодержащих соед.:
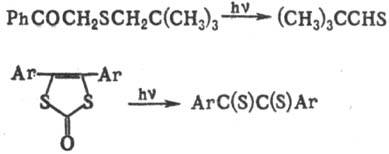
Для получения тиоальдегидов используют также нуклеоф. расщепление сульфенилхлоридов, сульфениламидов, тио-цианатов, сульфидов, дисульфидов, солей Бунте (S-алкил-тиосульфатов) либо расщепление мезоионных 1,3-дитиола-нов:
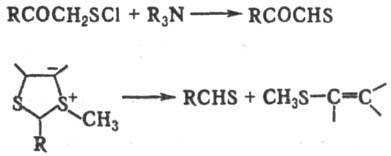
Тиокетоны м.б. получены из кетонов в условиях конденсации Клайзена:
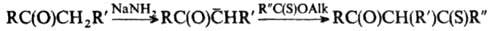
Ароматич. тиокетоны получают окислением Аr2СН2, Аr2С=САr2, Ar2CHNH2 и Ph2C=PPh3 элементной серой при 140-270 °С; тиоацшшрованием ароматич. соединений в условиях р-ции Фриделя-Крафтса, напр.:
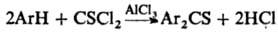
Тиокарбонильные соединения применяют в качестве интермедиатов в тонком орг. синтезе. Среди тиокарбонильных соединений найдены бактерициды и др. биологически активные препараты.
Лит.: Общая органическая химия, пер. с англ., т. 5, М., 1983; Usov V.A., Voronkov М. G., "Sulfur reports", 1982, v. 2, № 2, p. 39-85. В. А. Усов.
