Нитрохлорбензолы
НИТРОХЛОРБЕНЗОЛЫ, соед. общей ф-лы ClC6H5-n(NO2)n. Наиб. практич. интерес представляют мононитрохлорбен-золы (ф-ла I; мол. м. 157,56) и динитрохлорбензолы. Все мононитрохлорбензолы- светло-желтые кристаллы (см. табл.); 3-нитрохлорбензол существует в стабильной и метастабильной модификациях. Не раств. в воде, хорошо раств. в этаноле, диэтиловом эфире, бензоле, ацетоне, хлороформе.
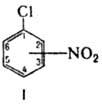
Большинство хим. превращений 2- и 4-нитрохлорбензолов связано с подвижностью атома Сl, обусловленной сильным электроноакцепторным действием группы NO2. В р-циях с разл. нуклеофилами атом Сl замещается на группы OAlk, Alk, OAr, NH2, NAlk2, CONH2 и CN.
3-Нитрохлорбензол в р-ции замещения атома Сl не вступает. 4-Нитрохлорбензол под действием Na2S2 образует 4,4'-динитродифенилдисулъфид-промежут. соед. в произ-ве сульфаниламидных препаратов. Восстановление нитрохлорбензолов в кислой среде приводит к соответствующим аминопроизводным, напр. при действии на 4-нитрохлорбензола SnCl2 в НСl образуется 4-хлор-анилин. В щелочной среде Zn и Fe восстанавливают нитрохлорбензолы до гидразосоединений; напр., 2-нитрохлорбензол превращ. в 2,2'-дихлоргидразобензол, к-рый при подкислении перегруппировывается в 3,3'-дихлорбензидин. Р-ции электроф. замещения идут по ароматич. ядру, причем заместитель входит, как правило, в мета-положение по отношению к группе NO2. Так, хлорирование 4-нитрохлорбензола хлором приводит к 1,2-дихлор-4-нитробензолу, сулъфирование под действием Н2SО4-к 2-хлор-5-нитро-бензолсульфокислоте; 2-нитрохлорбензол при сульфировании превращ. в 3-нитро-4-хлорбензолсульфокислоту. Нитрование нитрохлорбензолов нитрующей смесью (56% H2SO4, 30% HNO3 и 14% H2O) при 65 °С приводит к образованию динитрохлорбензолов. Так, при нитровании 2-нитрохлорбензола образуется смесь 2,4-динитрохлор-бензола (основной продукт), 2,6- и 3,4-динитрохлорбензолов, при нитровании 4-нитрохлорбензола-2,4-динитрохлорбензол.
СВОЙСТВА МОНОНИТРОХЛОРБЕНЗОЛОВ

* Стабильная модификация, nD80 1,5374. ** nD100 1,5376.
В пром-сти 2- и 4-нитрохлорбензолы получают нитрованием хлорбензола при 40-70°С нитрующей смесью (52,5% H2SO4, 35,5% HNO3 и 12% Н2О) по непрерывной технологии. Образующуюся смесь изомеров (34% 2-нитрохлорбензола, 65% 4-нитрохлорбензола и 1% 3-нитрохлорбензола) охлаждают до 15°С; при этом большая часть 4-нитрохлорбензола выкристаллизовывается. Из остатка фракционной перегонкой с послед. кристаллизацией выделяют 2-нитрохлорбензол (3-нитрохлорбензол при такой схеме процесса обычно не выделяют). 3-Нитрохлорбензол получают хлорированием нитробензола в присут. иода. Др. лаб. способы получения нитрохлорбензолов-диазотирование соответствующих нитроани-линов и взаимод. нитрофенолов с РСl5.
Аналит. определение нитрохлорбензолов осуществляют, восстанавливая их в соответствующие амины; последние с фенолом и NaClO дают синее окрашивание.
2- И 4-нитрохлорбензолы- сырье для произ-ва нитроанилинов, анизидинов, нитро- и аминофенолов, n-фенилендиамина, динитрохлорбензолов, 1,2-дихлор-4-нитробензола-промежут. продуктов в синтезе азокрасителей, сернистых красителей, пигментов, ингибиторов коррозии, реактивов для фотографии, инсектицидов (напр., паратиона), лек. ср-в. 3-Нитрохлорбензол используют только в орг. синтезе.
Нитрохлорбензолы токсичны при вдыхании и попадании внутрь, раздражают кожу. Окисляют гемоглобин крови в метгемоглобин (наиб. действием обладает 3-нитрохлорбензол), отрицательно действуют на ф-цию печени, тройничный и зрительный нервы, вестибулярный аппарат, вегетативную нервную систему. ПДК 1 мг/м3.
Произ-во в США 2-нитрохлорбензола 25 тыс. т, 4-нитрохлорбензола 45 тыс. т (1981).
Лит. см. при ст. Нитросоединения. В. И. Ерашко.
