Нитробензол
НИТРОБЕНЗОЛ (мирбановое масло) С6Н5МО2, мол. м. 123,11, бесцв. или зеленовато-желтая маслянистая жидкость с запахом горького миндаля; т. пл. 5,85 °С, т. кип. 211,03°С, 108,2°/30 мм рт.ст.; d420 1,2037; пD20 1,1562, h 2,165 мПа.с (15°С), 1,634 мПа.с (30°С); g 4,335.10-6 Н/м; С0р 0,1774 кДж/(кг.К); DH0обр -17,165 кДж/моль, DH0сгор (для жидкости) -3094,88 кДж/моль, DH0исп 46,05 кДж/моль, DH0возг 58,19 кДж/моль. При — 30 °С - кристаллы моноклинной сингонии (а = 0,386 нм, b = 1,165 нм, с = 1,324 нм, b = 95,58 °, z = 4). Плохо раств. в воде (0,19% по массе при 20 °С, 0,8% при 80 °С); смешивается во всех отношениях с диэтиловым эфиром, бензолом; хорошо раств. в др. орг. р-рителях, перегоняется с водяным паром.
По хим. св-вам - типичное ароматич. нитросоединение. Электроф. замещение (хлорирование, нитрование, сульфи-рование) протекают труднее, чем для бензола, что обусловлено сильным электроноакцепторным действием группы NO2. Замещение идет преим. в мета-положение. Нитрование нитробензола протекает по схеме 1 или 2:
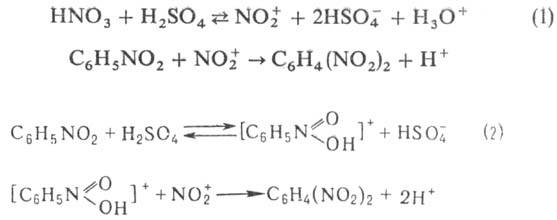
Нуклеоф. замещение протекает легко; второй заместитель вступает в орто- или nара-положение, напр. сплавление с КОН при 100°С приводит к о-нитрофенолу. Нитробензол не вступает в р-цию Фриделя-Крафтса. Восстановление нитробензола зависит от природы восстановителя и условий проведени- р-ции. При восстановлении металлами (Fe, Zn или Sn) в кислой среде, сульфидами металлов, Н2 в присут. металлич. катализаторов или SnCl2 в СН3СООН нитробензол превращ. в анилин; при
действии Zn в щелочной среде или LiAlH4 образует смесь азо- и азоксибензолов, превращающихся затем в гидразо-бензол, а при взаимод. с Ка3АsО3-азоксибензол. Обработка нитробензола Zn в нейтральной среде приводит к N-фенил-гидроксиламину, смесью Na2S2O3 с Na3PO4-K фенилсуль-фамату Na. При электрохим. восстановлении в сернокислой среде нитробензол превращ. в n-аминофенол.
В пром-сти для получения нитробензола используют непрерывный процесс нитрования бензола смесью конц. HNO3 и H2SO4; выход 96-99%. В лаборатории нитробензол получают добавлением бензола к смеси HNO3 (плотн. 1,4 г/см3) и H2SO4 (1,84 г/см3) в соотношении 1:1 при 55-60°С; время выдержки 45 мин; выход 81%.
Определяют нитробензол полярографически или восстановлением с помощью ТlСl2 или TiSO4 в кислой среде с послед. оттитровыванием избытка Ti2+, а также переведением нитробензола в м-динитробензол с определением последнего колориметрически. Нитробензол окрашивает 10%-ный р-р КОН в розовый цвет.
Нитробензол токсичен, впитывается через кожу; оказывает сильное действие на центр. нервную систему, нарушает обмен в-в, вызывает заболевания печени, окисляет гемоглобин в мет-гемоглобин; ПДК 3 мг/м3. Т. всп. 88 °С, т. воспл. 482 °С.
Нитробензол-исходное сырье в произ-ве анилина, ароматич. азотсодержащих соед. (напр., бензидина, хинолина, азобензола); р-ритель эфиров целлюлозы; компонент полировальных составов для металлов.
В США ежегодно производится более 250 тыс. т нитробензола.
Лит.: Орлова Е.Ю., Химия и технология бризантных и взрывчатых веществ, 3 изд., Л., 1981; Kirk-Othmer encyclopedia, 3 ed., v. 15, N. Y., 1981.
