Фосфора галогениды
ФОСФОРА ГАЛОГЕНИДЫ, тригалогениды PX3, пентагало-гениды PX5 (X = F, Cl, Br), смешанные галогениды, напр. PClF2, PCl2F3, окси- POX3 и тиогалогениды PSX3, низшие галогениды - галогениды P(II), напр. P2Cl4, P2I4. Св-ва фосфора галогенидов приведены в табл. PCl3, PBr3, POCl3, PSCl3, P2Cl4 - бесцв. жидкости; PI3 - красные кристаллы гексаген, сингонии; PCl5 - бесцв. зеленоватые кристаллы тетрагон. сингонии; POBr3 -бесцв. кристаллы; PBr5 - красновато-желтые кристаллы ром-бич, сингонии; P2I4 - оранжевые кристаллы триклинной сингонии, т.пл. 126,1 0C, плотн. 4,18 г/см3; остальные - бесцв. газы. Молекулы фосфора галогенидов сравнительно малополярны.
СВОЙСТВА НЕКОТОРЫХ ГАЛОГЕНИДОВ ФОСФОРА
| Соединение | Т.пл., 0с | T. кип., 0с | Плотн., г/см3 | Дж/(моль •К)а | кДж/моль | Дж/(моль·К) | ||
| PF3 | -151,5 | -101,5 | 3,907 г/л | 58,69 | -957,4 | 272,95 | ||
| PCl3 | -90,34 | 75,3 | 1,57 | 71,59 | -289,5 | 311,60 | ||
| PBr3 | -40,5 | 175,3 | 2,87 | — | -175,7б | 57,4б | ||
| PI3 | 61,0 | Разлагается | 3,89 | — | -46,0в | — | ||
| PF5 | -93,75 | -84,55г | 5,805 г/л | 84,70 | -1593,3 | 300,92 | ||
| PCl5 | 160 | 159г | 2,11 | 113,32 | -376,0 | 367,11 | ||
| PBr5 | — | 106 (с разл.) | 3,57 | — | -230,0в | — | ||
| PFCl4 | -60,0 | — | — | 107,85 | -646,1 | 357,89 | ||
| PClF4 | -132 | — | — | 93,0 | -1365,0 | 326,76 | ||
| PCl2F3 | -125 | 10 | 5,4 г/л | 97,35 | -1122,1 | 335,33 | ||
| PBr2F3 | -20 | — | — | — | — | — | ||
| POF3 | 39,8 | -40,15 | 3,7д | 68,87 | -1252,0 | 285,31 | ||
| POCl3 | 1,18 | 107,2 | 1,65 . | 84,35 | -568,4 | 324,5 | ||
| POBr3 | 55,0 | 192 | 2,82 | — | -479,5в | — | ||
| PSCl3 | -36,2 ( | 125 | 1,63 | | | | ||
| P2Cl4 | -28,0 (с разл.) | — | — | — | — | — | ||
| P2I4 | 126,1 | — | 4,18 | — | — | — | ||
а Для газа. б Для жидкости. в Для кристаллов.г Т-ра возгонки.д Относительно воздуха.
Молекулы PX3 имеют конфигурацию тритон, пирамиды с атомом P в вершине. Длина связи P — X меняется от 0,155 нм для PF3 до 0,255 нм для PI3, угол XPX ~ 100°. Полярность молекул падает при переходе от PF3 к PI3, т-ра плавления растет в результате увеличения межмол. взаимодействия. Трихлорид PCl3 дымит во влажном воздухе (из-за гидролиза с выделением HCl), энергично взаимод. с водой, образуя фосфористую и соляную к-ты. Хорошо раств. в диэтиловом эфире, бензоле, CHCl3, CS2, CCl4. Получают пропусканием Cl2 в р-р белого P в CS2 или сжиганием P в атмосфере сухого Cl2. Применяют для получения PCl5, POCl3, PSCl3, фосфор-орг. соед., в произ-ве красителей, лек. ср-в, инсектицидов (эфиры тиофосфорных к-т) и ПАВ. Токсичен, ПДК 0,2 Мг/м3.
Молекулы пентахлорида PCl5, находящегося в жидком или газообразном состоянии, имеют конфигурацию три-гон. бипирамиды с атомом P в основании. Расстояния Cl-Cl в основании бипирамиды 0,308 нм, длина экваториальной связи P-Cl 0,21 нм, апикальной - 0,225 нм. Твердый PCl5 построен из тетраэдрич. ионов 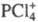 и октаэдрических
и октаэдрических 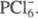 Длина связей P — Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные). В парах выше 300 0C полностью разлагается на PCl3 и Cl2, DH р-ции 129,7 кДж/моль. Гидролизуется водой сначала до POCl3, затем до H3PO4. Лучший р-ритель для PCl5- CCl4, раств. также в CS2. При взаимод. PCl5 с NH4Cl получается фосфонитрил-хлорид PNCl2, образующий при 120-150 0C циклич. тример, к-рый выше 300 0C дает неорг. полимер (Cl2P = N)n (см. Полифосфазены). Получают PCl5 взаимод. PCl3 с избытком Cl2, а также пропусканием Cl2 в р-р PCl3 в CS2. PCl5 -хлорирующий агент, его используют при получении хлоран-гидридов фосфорных к-т, фосфоновых к-т из олефинов, в произ-ве лек. ср-в и красителей. Токсичен, ПДК 0,2 мг/м3.
Длина связей P — Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные). В парах выше 300 0C полностью разлагается на PCl3 и Cl2, DH р-ции 129,7 кДж/моль. Гидролизуется водой сначала до POCl3, затем до H3PO4. Лучший р-ритель для PCl5- CCl4, раств. также в CS2. При взаимод. PCl5 с NH4Cl получается фосфонитрил-хлорид PNCl2, образующий при 120-150 0C циклич. тример, к-рый выше 300 0C дает неорг. полимер (Cl2P = N)n (см. Полифосфазены). Получают PCl5 взаимод. PCl3 с избытком Cl2, а также пропусканием Cl2 в р-р PCl3 в CS2. PCl5 -хлорирующий агент, его используют при получении хлоран-гидридов фосфорных к-т, фосфоновых к-т из олефинов, в произ-ве лек. ср-в и красителей. Токсичен, ПДК 0,2 мг/м3.
Молекула оксихлорида POCl3 имеет форму искаженного тетраэдра с атомом P в центре;  8,01· 10-30 Кл·м.. Полярный р-ритель, подвергается самоионизации (POCl3
8,01· 10-30 Кл·м.. Полярный р-ритель, подвергается самоионизации (POCl3 POCl+2+ С1-), раств. неорг. соли, напр. NaCl, NH4Cl. Хорошо раств. в бензоле, CHCl3, CCl4, CS2. Сильно дымит во влажном воздухе, гидролизуется водой до H3PO4. Получают пропусканием O2 через PCl3 при 20-50 0C, взаимод. PCl5 с P2O5 или H2C2O4. Применяют для получения инсектицидов, орг. фосфатов H3PO4, в частности трибутилфосфата. Токсичен, ПДК в воздухе рабочей зоны 0,05 мг/м3.
POCl+2+ С1-), раств. неорг. соли, напр. NaCl, NH4Cl. Хорошо раств. в бензоле, CHCl3, CCl4, CS2. Сильно дымит во влажном воздухе, гидролизуется водой до H3PO4. Получают пропусканием O2 через PCl3 при 20-50 0C, взаимод. PCl5 с P2O5 или H2C2O4. Применяют для получения инсектицидов, орг. фосфатов H3PO4, в частности трибутилфосфата. Токсичен, ПДК в воздухе рабочей зоны 0,05 мг/м3.
Тиохлорид PSCl3 по св-вам близок к POCl3; получают взаимод. S с PCl3 в автоклаве в присут. AlCl3. Используют в произ-ве инсектицидов (эфиры тиофосфорных к-т).
Фториды и бромиды P получают из простых в-в, PF5 применяют в произ-ве фторофосфатов, как ингибитор коррозии металлов в среде N2O4.
Лит.: Везер В.-Дж., Фосфор и его соединения, пер. с англ., M., 1962; У га и Я. А., Неорганическая химия, M., 1989. Я. А. Угай.

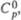
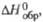
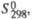
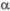 -форма) -40,8 (b)
-форма) -40,8 (b)