Аммониевые соединения
АММОНИЕВЫЕ СОЕДИНЕНИЯ, содержат положительно заряженный атом N, связанный ковалентно с орг. остатками и (или) водородом и ионной связью с анионом.
Простейшие неорг. аммониевые соединения-гидроксид и соли аммония (см., напр., Аммония нитрат, Аммония сульфат).
Орг. аммониевые соединения в зависимости от числа орг. остатков у атома N подразделяют на первичные [RNH3]+X-, вторичные [R2NH2]+X-, третичные [R3NH]+X- и четвертичные [R4N]+X-. Соед. с пятиковалентным атомом N не существует. Известны внутр. четвертичные аммониевые соли, напр. бетаин (СН3)3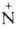 СН2СОО-. К аммониевым соединениям часто относят все орг. соед., содержащие ониевый атом N, напр. соли пиридиния и др. гетероциклич. производных, гидразиния, гидроксиламмония, нитрилия [RC
СН2СОО-. К аммониевым соединениям часто относят все орг. соед., содержащие ониевый атом N, напр. соли пиридиния и др. гетероциклич. производных, гидразиния, гидроксиламмония, нитрилия [RC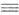 NR'] + X -.
NR'] + X -.
Обычно первичные, вторичные и третичные аммониевые соли рассматривают как соли аминов. Они образуются при взаимод. аминов с к-тами. Под действием р-ров щелочей из солей аминов, к-рые являются слабыми основаниями и не раств. в воде, выделяется исходный амин; соли аминов, обладающих сильными основными св-вами и растворяющихся в воде, превращаются в гидроксиды, к-рые устойчивы только в водных р-рах и уже при их упаривании легко теряют Н2О," давая исходный амин. Этот прием используется для очистки аминов. К ониевым соед. относят обычно только четвертичные аммониевые соли.
Четвертичные аммониевые соли-кристаллы. Их получают гл. обр. алкилированием (т. наз. кватернизация) третичных аминов алкилгалогенидами: R3N + R'X -> [R3NR']+X-. Скорость р-ции убывает в ряду: иодиды > бромиды > хлориды и резко возрастает при использовании биполярных апротонных р-рителей, напр. ДМСО, ДМФА. Алкилирующими агентами м. б. также диалкилсульфаты, эфиры арилсульфоновых к-т и др.
Особый тип солей аммония -иминиевые соли.
При действии р-ров едких щелочей на четвертичные соли образуются четвертичные аммониевые основания, равные по силе КОН и NaOH (поэтому р-ция равновесна):
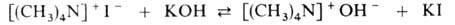
Чистые основания обычно получают действием AgOH на четвертичные соли:
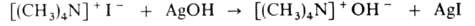
Четвертичные аммониевые основания-кристаллы, расплывающиеся на воздухе. При 100-150°С разлагаются, причем по-разному в зависимости от строения радикалов. Так, из [(CH3)4N]+OH- или [(C6H5CH2)4N]+ОН- образуются третичные амины и спирты. При наличии атома Н в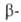 положении по отношению к атому N распад идет с выделением третичного амина, олефина и воды (расщепление по Гофману):
положении по отношению к атому N распад идет с выделением третичного амина, олефина и воды (расщепление по Гофману): 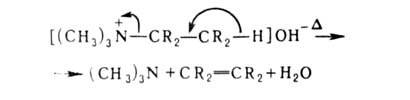
В смеси безводных ТГФ и ДМСО четвертичные основания расщепляются уже при комнатной т-ре.
Метилирование амина до четвертичной аммониевой соли (кватернизация), превращение последней в основание и его распад (метод исчерпывающего метилирования) применяются при изучении прир. алкалоидов и др. азотистых оснований.
При действии C6H5Li на [(CH3)4N]+C1- от одного из атомов углерода отщепляется атом Н и образуется триметиламмонийметилид (СН3)3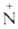 —СН2-внутренняя аммониевая соль. Подобные илиды образуются при Стивенса перегруппировке. Напр., гидроксид фенацилбензилдиметиламмония в водном р-ре гладко превращается в
—СН2-внутренняя аммониевая соль. Подобные илиды образуются при Стивенса перегруппировке. Напр., гидроксид фенацилбензилдиметиламмония в водном р-ре гладко превращается в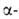 бензил-
бензил-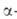 диметиламиноацетофенон:
диметиламиноацетофенон: 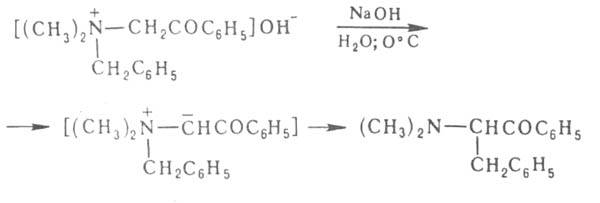
Соли бензиламмониев могут претерпевать и перегруппировку Соммле-Хаузера: 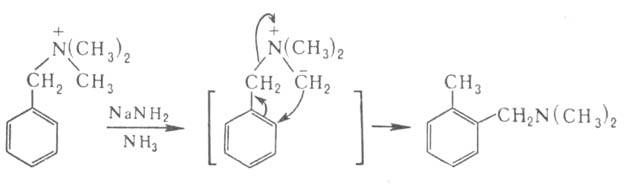
При восстановлении четвертичных солей, содержащих двойную связь в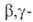 положении, расщепляется связь С—N:
положении, расщепляется связь С—N: 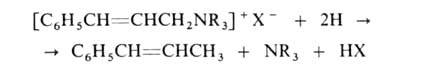
Четвертичные аммониевые соли, содержащие хотя бы одну длинную алкильную цепь, обладают поверхностно-активными и антисептич. св-вами; их применяют как эмульгаторы, стабилизаторы, смачиватели, дезинфицирующие ср-ва. Четвертичные соли используются как лек. препараты (метацин, кватерон, бензогексоний и др.), как катализаторы межфазного переноса. Четвертичные основания, напр. [(CH3)4N]+ОН- (тритон В), [(CH3)2N (CH2C6H5)2]+ОН-(тритон Г), - р-рители для целлюлозы; применяются также для омыления жиров и др.
Орг. аммониевые соединения встречаются в природе. Так, во мн. растениях содержатся алкалоиды в виде солей; простейшая четвертичная соль [(CH3)4N]+X- найдена в морских анемонах и нек-рых растениях; холин [(CH3)3NCH2CH2OH]+OH-и ацетилхолин-важные физиологические активные соединения.
Литература
Яновская Л.А., Юфит С.С., Органический синтез в двухфазных системах, М., 1982; Юфит С. С., Механизм межфазного катализа, М., 1984; Общая органическая химия, пер. с англ., т. 3, М., 1982; Вебер В., Гркель Г., Межфазный катализ в органическом синтезе, пер. с англ., М., 1980; Kirk-Othmer encyclopedia, 3 ed., v. 2, N.Y.-[a.o.], 1978, p. 516-36. Т.П. Толстая.
