Способы получения моногалогеналканов
1. Действие галоидов на предельные углеводороды на свету (реакция металепсии)
Например:
СН4 + Cl2 ------> СН3Cl + НCl
Замещение может идти и дальше с образованием полигалоидных соединений.
Из галоидов энергичнее всех действует фтор; однако эта реакция протекает очень бурно и часто сопровождается взрывами и обугливанием вещества; поэтому такой способ применяется для препаративных целей только в особых, тщательно разработанных условиях. Весьма энергично действует хлор, труднее — бром и всего труднее—иод. Реакция с иодом

обратима, а следовательно, может идти до конца только тогда, когда образующийся йодистый водород удаляется. Это достигается прибавлением окиси ртути (образуется йодная ртуть) или йодноватой кислоты, которая окисляет йодистый водород с выделением иода по уравнению

2. Получение из спиртов
Из спиртов галоидные соединения могут быть получены различными способами. Наиболее обычными из этих способов являются действие галоидных соединений фосфора и действие галоидоводородных кислот.
Взаимодействие пятигалоидных соединений фосфора со спиртами протекает по уравнению
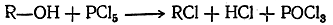
При нагреваний может реагировать со спиртами и бромокись (хлорокись) фосфора:
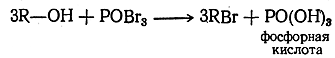
Аналогично реагируют трехгалоидные соединения фосфора, например:
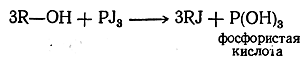
Для реакции можно брать не готовые галоидные соединения фосфора, а отдельно фосфор и галоид, причем в последнем случае возникающие галоидные соединения реагируют со спиртом в момент своего образования.
Так можно получать бромистые и йодистые ал.килы, но с треххлористым фосфором реакция идет по-разному в зависимости от строения спирта. Первичные спирты образуют лишь небольшое количество галоидпроизводных, а главным образом получаются эфиры фосфористой' кислоты:

Третичные спирты превращаются в соответствующие алкил-хлориды:
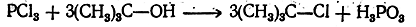
а вторичные спирты дают смесь двузамещенных эфиров фосфористой кислоты и хлористых алкилов:
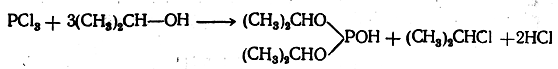
С галоидоводородными кислотами спирты реагируют по уравнению

Такие реакции обратимы; следовательно, чтобы реакция дошла практически до конца, необходимо вводить в реакцию как можно меньше воды, т. е. применять возможно более концентрированные кислоты, или, еще лучше, насыщать спирт газообразным галоидоводородом.
Из галоидоводородных кислот легче всего реагирует со спиртами иодистоводородная кислота и труднее всего — хлористоводородная кислота. Однако и последняя легко вступает в реакцию в момент образования (например, если поваренную соль облить спиртом и к смеси прибавлять концентрированную серную кислоту). Из спиртов легче всего реагируют третичные, труднее — вторичные, еще труднее — первичные. В последнем случае прибегают иногда к добавкам в реакционную смесь ZnCl2 или СаCl2.
3. Присоединение галоидоводородов к этиленовым углеводородам
Например:
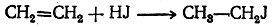
Концентрированная фтористоводородная кислота не присоединяется к олефинам; реакция идет лишь с безводным H2F2 (лучше под давлением). Однако реакция присоединения обычно осложняется реакциями полимеризации. Поэтому фтористые алкилы часто получают действием, например, фтористого серебра на йодистые алкилы:
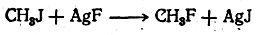
Физические свойства. Если сравнить физические свойства соединений, содержащих различные галоиды (табл. 2), то можно видеть, что ниже всего температуры кипения фтористых соединений, у хлористых соединений они ниже, чем у бромистых, и выше всего у йодистых. Из фтористых алкилов фтористые метил, этил, пропил и изопропил являются газами, из хлористых алкилов хлористый метил и хлористый этил — вещества газообразные, из бромистых алкилов газом является лишь бромистый метил, а йодистый метил — уже жидкость. Из изомерных соединений при наиболее высоких температурах кипят нормальные первичные, ниже кипят вторичные и наиболее низко — третичные соединения.
Плотности йодистых соединений — наиболее высокие, фтористых — наиболее низкие. При переходе от низших гомологов к высшим плотности уменьшаются: для первых гомологов быстро, а затем — медленнее. Бромистые и йодистые соединения—тяжелее воды. Галоидные алкилы бесцветны, нерастворимы в воде, легко растворяются в спирте и эфире.
Низшие гомологи хлористых и бромистых соединений обладают характерным сладковатым запахом, при вдыхании действуют анестезирующим образом. Фтористые соединения сначала действуют также анестезирующе, а при длительном воздействии поражают органы дыхания (это обусловлено легкостью гидролиза алкилмонофторидов и отщепления от них фтористого водорода). Характерный запах йодистых соединений мало походит на запах соединений остальных галоидов; на свету йодистые соединения окрашиваются в бурый цвет вследствие разложения их с выделением иода.


