Металлоцeны
МЕТАЛЛОЦEНЫ, дициклопентадиенильные соед. переходных металлов общей ф-лы (h-С5Н5)2М. Получены для большинства d-элементов. Имеют структуру "сэндвича" - металл в степени окисления + 2 располагается между двумя лежащими в параллельных плоскостях циклопентодиенильными кольцами на равном расстоянии от всех атомов С. В большинстве металлоценов связь металла с лигандами ковалентна; исключение - манганоцен, в к-ром свявь обусловлена элект-ростатич. взаимод. катиона Мn2+ с анионами С5Н-5. Частично ионный характер имеют также хромоцен и ванадоцен. В кристаллич. состоянии ферроцен находится в заторможенной антипризматич. или призматич. конформации, ру-теноцен и осмоцен-в призматической (ф-ла I).
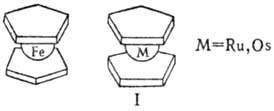
Металлоцены-интенсивно окрашенные кристаллы, хорошо раств. в орг. р-рителях, возгоняются. Соед., имеющие у иона металла оболочку благородного газа (ферро цен, рутеноцен и осмоцен), устойчивы на воздухе, выдерживают нагревание выше 400 СС. Такие металлоцены проявляют арома-тич. св-ва, в частности атом водорода замещается при действии электроф. реагентов (сульфирование, ацилирова-ние по Фриделю - Крафтсу, меркурирование, металлирова-ние и др.). Ограниченно устойчив никелоцен. Остальные металлоцены очень быстро разрушаются на воздухе. С акцепторами электронов, напр. n-хлоранилом, тетрацианоэтиленом, металлоцены образуют комплексы с переносом заряда. Большинство металлоценов окисляется до металлоцениевых катионов [(С5Н5)2М]+ или [(С5Н5)2М]2+ , к-рые существуют обычно в кислых водных р-рах, осаждаются в виде солей с комплексными анионами -PFe-6, BF-4, PtCl2-6, Ph4B- и др. Ионы кобальтоцения, родоцения и иридоцения исключительно устойчивы к действию окислителей - не разрушаются при нагр. с конц. HNO3 и царской водкой.
Никелоцен легко обменивает циклопентадиенильные кольца на др. лиганды при действии разнообразных реагентов -Ni(CO)4, NO, PPh3, KCN в жидком аммиаке, CH2=CHCH2MgX, HC=CH и др. Непредельные соед. (СН3ООСС=ССООСН3, CF2=CF2 и др.) присоединяются к одному кольцу никелоцена с образованием нового ли-ганда, имеющего иной характер связи с Ni.
Кобальтоцен медленно реагирует с водой с выделением Н2 и образованием [(С5Н5)2Со] + . При действии на него галогенсодержащих орг. соед. (ССl4, CH3I, PhCH2Cl и др.) образуются соль кобальтоцения и нейтральные устойчивые комплексы, напр. p-С5Н5СоС5Н5ССl3 при р-ции с ССl4.
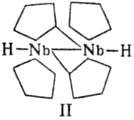
Металлоцены элементов начала больших периодов электроне дефицитны и в ряде р-ций ведут себя аналогично карбенам: очень неустойчивы к окислению и нагреванию. Так, ниобоцен, полученный только в растворе, при комнатной температуре быстро превращ. в биядерный комплекс (II).
Металлоцены получают р-цией солей или ацетилацетонатов переходных металлов с циклопентадиенидами щелочных металлов, Mg, T1; действием циклопентадиена на соль (в присут. основания) или карбонил металла. При взаимод. галогенидов нек-рых металлов с C5H5Na+ образуются не металлоцены, а их производные - галогениды или гидриды, например (C5H5)2TiCl2, (C5H5)2ReH, (C5H5)2MoH2. В таких производных кольца расположены непараллельно.
Металлоцены-катализаторы и сокатализаторы в гомог. каталитич. р-циях, лек. препараты, присадки к топливам и маслам, промежут. продукты в орг. синтезе.
Первый металлоцен (ферроцен) синтезировал в 1951 П. Посон с сотрудниками, его "сэндвичевая" структура установлена в 1952 Р. Вудвордом и Дж. Уилкинсоном.
Исп. литература для статьи «МЕТАЛЛОЦEНЫ»: Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, ч. 3, пер. с англ., М., 1969; Перевалова Э. Г., Никитина Т. В., в сб.: Методы элементоорганической химии. Типы металлоорганических соединений переходных металлов, кн. 2, под общ. ред. А. Н. Несмеянова и К. А. Кочеткова, М., 1975, с. 687-726. Э.Г. Перевалова.
