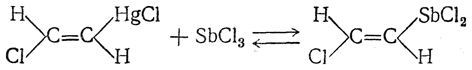I. Реакции присоединения
1. Присоединение водород а. При присоединении одной молекулы водорода к тройной связи получается этиленовый углеводород:
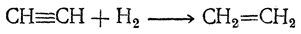
Реакция идет при действии натрием в спиртовой среде (восстановление водородом в момент выделения), а также с молекулярным водородом над палладиевым катализатором.
При дальнейшем восстановлении получается парафиновый углеводород:
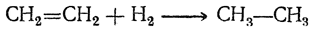
2. Присоединение галоидов. Галоиды также присоединяются к тройной связи или с образованием двузамещенного галоидпроизводного этиленового углеводорода (присоединение одной молекулы галоида), или с образованием четырехзамещенных галоидпроизводных парафиновых углеводородов (присоединение двух молекул галоида):
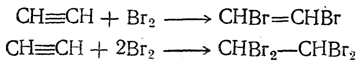
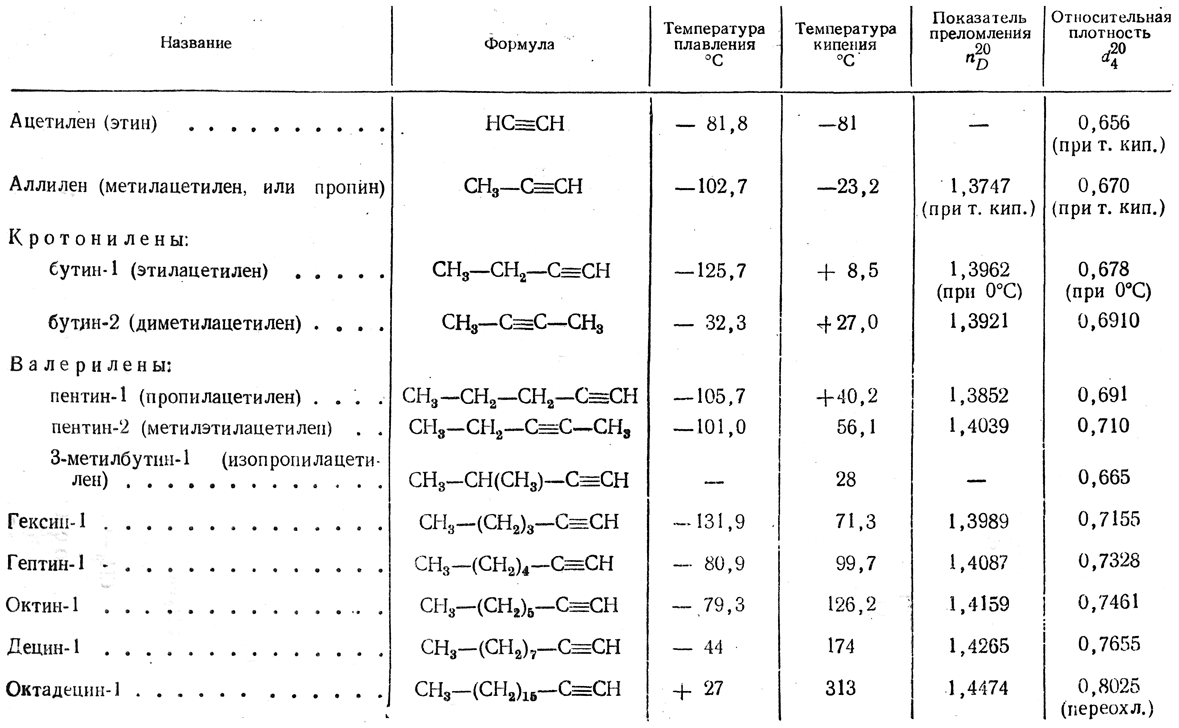
Присоединение хлора к ацетилену в газовой фазе идет очень бурно и может сопровождаться взрывами. Поэтому хлорирование осуществляют в жидкой фазе, в среде готового продукта присоединения хлора (тетрахлорэтана) в присутствии треххлористой сурьмы в качестве катализатора:
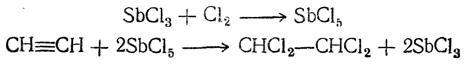
Таблица 18. Ацетиленовые углеводороды
3. Присоединение галоидоводородов. Присоединение одной молекулы галоидоводорода ведет к моногалоидпроизводным этилена:
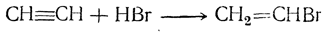
Присоединение второй молекулы галоидоводорода приводит к образованию двузамещенных производных этана:
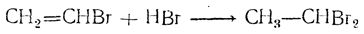
При этом водород направляется к более гидрогенизированному атому углерода, так что получается соединение, содержащее оба атома галоида при одном атоме углерода:
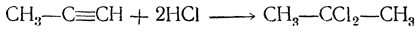
Таким образом, оказывается возможным от соединений с двумя атомами галоида у соседних атомов углерода перейти через ацетиленовые углеводороды к соединениям с двумя атомами галоида у одного и того же атома углерода; от соединений, получающихся из альдегидов, например СН3—СН2—СНСl2 можно перейти к соединениям, отвечающим кетонам: СН3—ССl2—СН3.
4. Присоединение воды. Вода легко присоединяется к ацетиленовым углеводородам под действием разных катализаторов, но особенно легко — в присутствии солей окиси ртути в сернокислотном растворе (М. Г. Кучеров, 1881). При этом из ацетилена получается уксусный альдегид, а из гомологов ацетилена — кетоны:
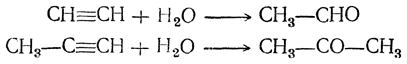
При присоединении воды, вероятно, сначала получается спирт этиленового ряда
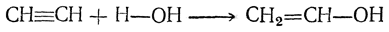
изомеризуюшийся затем в альдегид.
Предлагается и несколько иная схема механизма реакции Кучерова:
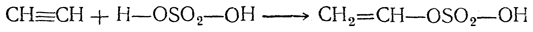
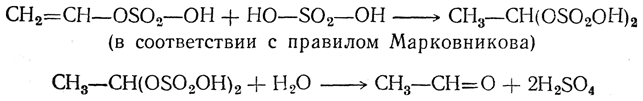
5. Присоединение спиртов. В присутствии кислых катализаторов, а особенно легко под действием едких щелочей (А. Е. Фаворский, М. Ф. Шостаковский) спирты присоединяются к ацетиленовым углеводородам, образуя виниловые эфиры,
например:
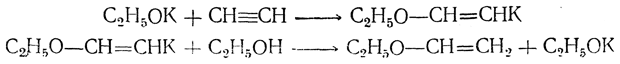
Аналогично спиртам могут реагировать меркаптаны и амины, давая соответствующие виниловые тиоэфиры (винилеульфиды) и виниламины:

Для винилирования кислот удобнее использовать их цинковые соли.
Винилироваться могут и другие соединения, содержащие подвижный атом водорода. Например, при винилировании бутиролактама винильная группа оказывается у атома азота, образуя N-винилпирролидон:
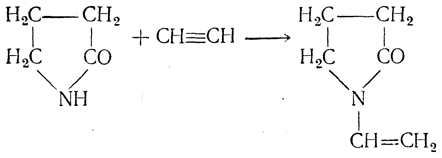
Полимеризацией этого винильного мономера получается поливинилпирролидон, называемый также гомовинилом, коллидином или перистоном, применяемый взамен плазмы при переливании крови. Эта синтетическая плазма может быть использована при любой группе крови, а кроме того, может храниться неограниченно долго
6. Присоединение альдегидов и кетонов. Ацетилен под небольшим давлением в присутствии некоторых смешанных катализаторов, содержащих, кроме меди, например, висмут, способен присоединяться к альдегидам. Так, при взаимодействии с формальдегидом (водным раствором) образуются спирты ацетиленового ряда:
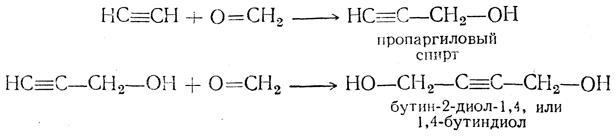
Аналогично могут идти синтезы и с другими альдегидами. Присоединение ацетилена к кетонам под влиянием амида натрия, а еще лучше в присутствии порошкообразного едкого кали (А. Е. Фаворский) протекает по схеме:
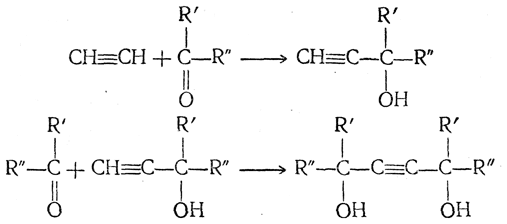
Эти реакции часто называют алкинольными синтезами. 7. Присоединение окиси углерода. Реакция ацетилена с окисью углерода может быть изображена схемой:
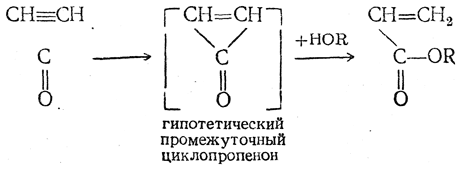
В присутствии воды образуется акриловая кислота, в присутствии спиртов — эфиры акриловой кислоты. Эти реакции идут в кислых растворах в присутствии карбонила никеля Ni(CO)4 или никелевых солей, обычно под давлением.
8. Присоединение галоидных солей. Галоидные соли некоторых элементов (HgCl2, AsCl3, SbCl3, TlCl2 и др.) присоединяются к ацетилену, например:
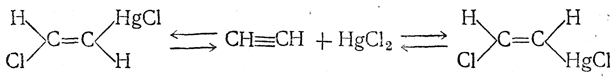
Получающиеся соединения обладают одновременно свойствами металлических комплексов и настоящих металлоорганических соединений. Они легко вступают в разнообразные реакции, широко изученные А. Н. Несмеяновым и его школой. Характерной особенностью этих реакций является их стереоспецифичность, выражающаяся в сохранении геометрических отношений при двойной связи: