Галоидангидриды угольной кислоты. Фосген (хлорокись углерода)
Как двухосновная кислота, угольная кислота могла бы иметь два ряда галоидангидридов:

Фосген (хлорокись углерода) СОСl2 является полным хлорангидридом угольной кислоты. Впервые это вещество получил Дэви (1811) в результате соединения окиси углерода с хлором на солнечном свету, откуда произошло и название фосген. В темноте, в отсутствие катализаторов, окись углерода и хлор соединяются лишь при повышенной температуре (500—600° С), причем в таких условиях эта реакция обратима. При 500°С равновесие достигается, когда смесь содержит 67% фосгена, а при 800° С фосген нацело разлагается на хлор и окись углерода.
Фотохимический процесс при обычной температуре также обратим. При облучении короткими ультрафиолетовыми лучами при обычной температуре равновесие достигается при содержании в реакционной смеси 96—97% фосгена.
С помощью катализаторов температуру реакции хлора с окисью углерода можно понизить. В промышленных условиях для получения фосгена применяется в качестве катализатора пористый уголь.
Фосген образуется также при действии кислорода при высокой температуре на четыреххлористый углерод и на хлороформ. Токсичность стоявшего на свету при доступе воздуха хлороформа объясняется частичным окислением его в фосген:
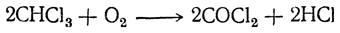
Фосген представляет собой газ, сгущающийся в жидкость с относительной плотностью 1,411 (при 4°С), кипящую при +8,2° С. Он очень хорошо растворяется в бензоле и толуоле. В промышленности получают или 20%-ный раствор фосгена в толуоле, или фосген, сгущенный в жидкость (в стальных баллонах).
Фосген ядовит; он обладает удушливым запахом и чрезвычайно сильно действует на слизистые оболочки и органы дыхания человека и животных. Благодаря этому свойству фосген применялся в первую мировую войну в качестве отравляющего вещества.
Подобно другим хлорангидридам, фосген обладает большой реакционной способностью, причем в реакциях последовательно участвуют один или оба атома хлора. С водой при обычной температуре он реагирует медленно, образуя углекислый газ и соляную кислоту:
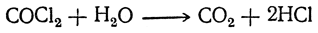
Гораздо легче эта реакция протекает в присутствии щелочи.
Со спиртами сначала вступает в реакцию один атом хлора с образованием эфиров хлоругольной кислоты:

Только при продолжительном действии спирта или при взаимодействии с алкоголятами фосген дает средний эфир угольной кислоты:
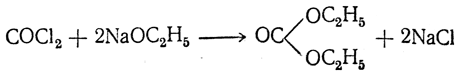
С аммиаком фосген образует мочевину:
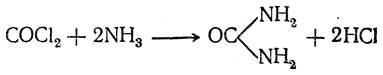
При пропускании фосгена через нагретый хлористый аммоний образуется хлорангидрид карбаминовой кислоты H2N—CO—Cl.
Фосген служит исходным веществом для многочисленных органических синтезов.
Фосген можно также рассматривать как производное формальдегида, а именно как дихлорформальдегид

Оксимом такого дихлорформальдегида является фосгеноксим, получающийся хлорированием гремучей кислоты (что достигается осторожным введением солей гремучей кислоты и хлора в концентрированную серную кислоту при охлаждении):

Фосгеноксим — бесцветное кристаллическое вещество, плавящееся при 39—40° С. Он обладает сильным общетоксическим и кожным действием.
При обработке гремучей ртути хлорцианом образуется цианистый аналог фосгеноксима — хлорцианоксим (кристаллы, т. пл. 56°С):
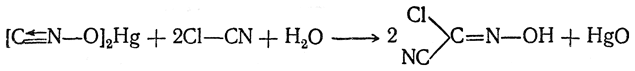
Фосгеноксим и хлорцианоксим водой не гидролизуются, а разрушаются только при действии щелочей.


