Микроэмульсии
МИКРОЭМУЛЬСИИ, многокомпонентные жидкие коллоидные системы (микрогетерог. жидкости), характеризующиеся термодинамич. устойчивостью. Обычно прозрачны или слабо опалесцируют. Образуются самопроизвольно при смешении двух жидкостей с ограниченной взаимной р-ри-мостью (в простейшем случае при смешении воды и углеводорода) в присут. мицеллообразующих ПАВ. Как правило, система содержит также электролит и немицеллообразую-щее ПАВ (спирт, амин, эфир или др.), наз. ко-ПАВ (или со-ПАВ). Размер частиц дисперсной фазы (микрокапсль) составляет 10-100 нм.
При изменении числа компонентов, состава или т-ры в системе происходят макроскопич. фазовые превращ., к-рые подчиняются фаз правилу и анализируются с помощью диаграмм состояния. Обычно строят "псевдотройные" диаграммы, рассматривая в качестве одного компонента углеводород (масло), в качестве другого-воду и электролит, в качестве третьего-ПАВ и ко-ПАВ. В плоскости треугольника составов (см. Многокомпонентные системы)кривая отделяет область 1 существования однородной (в макроскопич. смысле) микроэмульсии от областей, где микроэмульсия расслаивается (см. рис.). Однородная микроэмульсия в зависимости от состава или природы компонентов может представлять собой либо равномерную смесь (ко-солюбилизат) всех компонентов, либо лиотроп-ную жидкокристаллич. фазу (мезофазу). Непосредственно вблизи кривой сосуществуют набухшие мицеллярные системы типов ПАВ-вода с солюбилизир. углеводородом (область Г) и ПАВ - углеводород с солюбилизир. водой (область 1:). Расслаивающаяся микроэмульсия представляет собой набухшую мицеллярную систему углеводород-вода, к-рая в зависимости от условий (состав, т-ра, природа компонентов и др.) равновесно сосуществует либо с избытком почти чистого углеводорода (MI), либо с избытком воды (МII, либо с избытком обоих чистых компонентов (MIII).
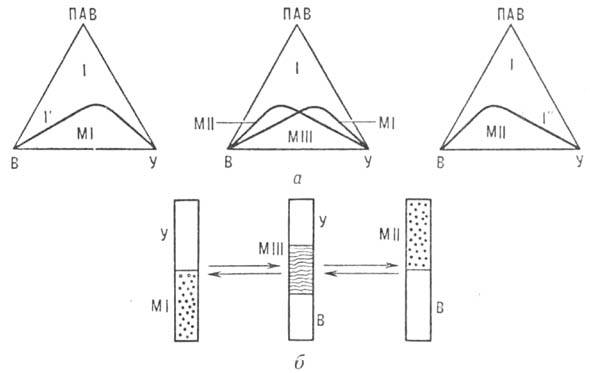
Концентрационные треугольники для системы вода (В) - углеводород (У)-ПАВ (а) и фазовые переходы между типами микроэмульсий (б). 1-однородная (в макроскопич. смысле) микроэмульсия, 1' и 1:-мицеллярные системы на основе ПАВ, MI, MII, MIII-расслаивающиеся микроэмульсии с избытком углеводорода, воды и обеих сред соответственно.
MI и МII, а также набухшие мицеллярные системы на основе ПАВ (области 1' и 1:) хорошо описываются моделью сферич. монодисперсных невзаимодействующих микрокапель, равномерно распределенных в дисперсионной среде, а именно: MI и система типа 1'-дисперсии микрокапель углеводорода в водной среде, МII и система типа 1:-дисперсия микрокапель воды в углеводородной среде. Микрокапли в этих дисперсиях стабилизированы монослоями ПАВ и ко-ПАВ. MIII не описываются сферич. моделью. Для них предложено неск. моделей, из к-рых наиб. распространение получила модель губчатой структуры с хаотич. распределением микрообластей воды и масла, разделенных тончайшими пленками (бислоями) ПАВ.
Фазовые переходы MI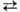 MIII
MIII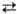 МII при постоянных т-ре и кол-вах воды и углеводорода вызываются изменением концентраций электролита, ПАВ или ко-ПАВ. На рис. схематически показан постепенный переход от MI (микрокапли углеводорода в воде) к MIII и МII (микрокапли воды в углеводороде). Наиб. подробно исследовано изменение содержания в системе электролита, к-рый влияет на межчастичное взаимод., а также изменяет коэффициент распределения ПАВ между водной и углеводородной средами.
МII при постоянных т-ре и кол-вах воды и углеводорода вызываются изменением концентраций электролита, ПАВ или ко-ПАВ. На рис. схематически показан постепенный переход от MI (микрокапли углеводорода в воде) к MIII и МII (микрокапли воды в углеводороде). Наиб. подробно исследовано изменение содержания в системе электролита, к-рый влияет на межчастичное взаимод., а также изменяет коэффициент распределения ПАВ между водной и углеводородной средами.
Помимо содержания электролита, фазовому переходу способствуют: увеличение длины алкильной цепи ПАВ, степень ароматичности масла, введение в качестве ко-ПАВ высших маслорастворимых спиртов, повышение т-ры (в случае не-ионогенных ПАВ). Фазовый переход наблюдается также при уменьшении длины цепи (числа атомов С) в углеводороде, уменьшении числа оксиэтиленовых групп в ПАВ, введении в качестве ко-ПАВ короткоцепочечных водорастворимых спиртов и снижение т-ры (для большинства ионогенных ПАВ).
Информацию о структуре микроэмульсий, состоянии межфазных пленок, межчастичных взаимод. и др. получают по данным светорассеяния, фотон-корреляц. спектроскопии, малоуглового рассеяния рентгеновских лучей и нейтронов, ЭПР, ЯМР и др.
Микроэмульсии-лиофильные системы (см. Лиофильность и лиофоб-ность). Образование микрокапель размером 5-10 нм соответствует очень низким значениям межфазного натяжения s12 на границе между равновесно сосуществующими жидкими фазами-до 10-2 -10-3 Н/м. При переходах MI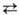 MIII или МII
MIII или МII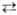 MIII значение s12 достигает 10-4-10-6 Н/м.
MIII значение s12 достигает 10-4-10-6 Н/м.
Для многих микроэмульсий найдены критич. точки, в к-рых исчезает граница между сосуществующими фазами. О приближении к критич. точке свидетельствует резкое повышение электрич. проводимости микроэмульсий (на 4-5 порядков), увеличение размера капель и их бесконечное агрегирование (перколяция). В рамках флуктуац. теории критических явлений радиус корреляции флуктуации концентрации (состава системы) связан степенной зависимостью с т-рой, кол-вом солюбилизиро-ванного в микрокапле компонента, концентрацией электролита и др.
Применение микроэмульсий обусловлено их способностью поглощать большие объемы воды или углеводородной жидкости, а также солюбилизировать в микрокаплях примеси и загрязнения. Перспективно использование микроэмульсий для повышения неф-теотдачи (коэф. извлечения нефти из пластов), поскольку системы типа MI (в избытке нефть) или МII (в избытке вода) характеризуются очень низкими значениями межфазного натяжения. Это позволит снизить расход ПАВ по сравнению с чисто водными дисперсиями ПАВ, закачиваемыми в пласт; кроме того, увеличивается подвижность нефти, облегчается ее отрыв от твердой породы, ускоряется слияние макрокапель нефти (коалесценция). Микроэмульсии обладают эффективным моющим и дезинфицирующим действием, являются удобной формой для диспергирования лек. ср-в, р-рителей и др., служат средой для проведения хим. р-ций (см. Мицеллярный катализ). Микроэмульсии являются комплексы вода-липид-белок, к-рые участвуют в метаболизме жиров, липо-протеинов и т. п. Микроэмульсии с перфторир. углеводородами-перспективные кровезаменители.
Исп. литература для статьи «МИКРОЭМУЛЬСИИ»: Мицеллообразование, солюбилизация и микроэмульсии, под ред. К. Миттeла, пер. с англ., М., 1980. Г. П. Ямпольская.
