Азосоединения
АЗОСОЕДИНЕНИЯ, содержат азогруппу — N=N—, связанную с атомами С двух одинаковых или разных орг. остатков. Общая ф-ла RN=NR'.
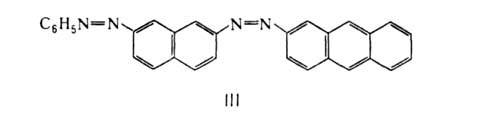
Названия азосоединений, у к-рых R=R', образуют, ставя частицу "азо" перед названием соединения, остатки к-рого входят в молекулу азосоединения, напр. азометан (R = R' = СН3), 1,1-азонафталин (R = R'= 1-нафтил). Если R и R'-разные, частицу "азо" располагают в середине названия азосоединения, напр. нафталин-2-азобензол (R = 2-нафтил, R' = C6H5), бензолазоацетоацетанилид (ф-ла I), З-метил-1-фенил-5-пиразолон-4-азобензол (II).
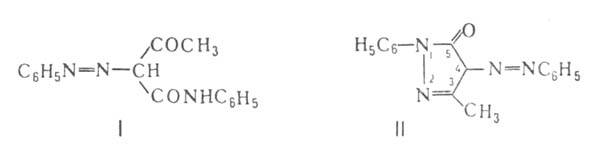
Группу ArN=N— можно рассматривать как заместитель. Тогда названия соответствующих азосоединений образуются, напр., так: n-фенилазобензолсульфокислота n-(C6H5N=N)— —C6H4SO3H, 2-(7-фенилазо-2-нафтилазо) антрацен (III):
Атомы N в азогруппе находятся в состоянии sp2-гибридизации, причем две из трех 5р2-орбиталей каждого атома участвуют в образовании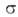 -связей, на третьей располагается неподеленная пара электронов, а
-связей, на третьей располагается неподеленная пара электронов, а -связь образуется за счет pz--орбиталей. В результате азогруппа нелинейна, что обусловливает существование цис- и транс-изомеров азосоединений. Стабильна транс-форма, к-рая превращается в цис-изомер при облучении р-ров светом длиной волны, соответствующей полосе поглощения облучаемого азосоединения.
-связь образуется за счет pz--орбиталей. В результате азогруппа нелинейна, что обусловливает существование цис- и транс-изомеров азосоединений. Стабильна транс-форма, к-рая превращается в цис-изомер при облучении р-ров светом длиной волны, соответствующей полосе поглощения облучаемого азосоединения.
Наличие неподеленных электронов создает возможность электронного п ->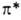 -перехода в азогруппе, приводящего к появлению полосы поглощения в электронном спектре: у алифатич. азосоединений - в УФ-области (160-ЗЮнм), у ароматических в результате сопряжения с кольцами-в длинноволновой области, напр. при 432 и 450 нм у цис-и транс-азобензолов соотв.; эти полосы характеризуются низкой интенсивностью, т. к. п ->
-перехода в азогруппе, приводящего к появлению полосы поглощения в электронном спектре: у алифатич. азосоединений - в УФ-области (160-ЗЮнм), у ароматических в результате сопряжения с кольцами-в длинноволновой области, напр. при 432 и 450 нм у цис-и транс-азобензолов соотв.; эти полосы характеризуются низкой интенсивностью, т. к. п ->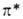 -переход в азогруппе запрещен по симметрии. Азогруппа обусловливает также появление интенсивной полосы
-переход в азогруппе запрещен по симметрии. Азогруппа обусловливает также появление интенсивной полосы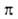 ->
->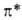 -перехода у ароматич. азосоединений в области 280-320 нм. Введение электронодонорного заместителя в сопряженное с азогруппой положение смещает полосу
-перехода у ароматич. азосоединений в области 280-320 нм. Введение электронодонорного заместителя в сопряженное с азогруппой положение смещает полосу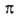 ->
->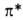 -перехода в видимую область спектра и азосоединение становится типичным красителем; введение электроноак-цепторного заместителя в сопряженное с азогруппой положение второго ароматич. остатка еще более усиливает это смещение. Соответствующим подбором заместителей в разных ароматич. остатках азосоединений можно добиться значит. углубления цвета азосоединений (см. Цветность органических соединений). Этот прием используется в синтезе азокрасителей. В ИК-спектрах характеристич. полосы поглощения vN=N у цис-изомеров и несимметричных азосоединений лежат в области 1400-1600 см -1; у ароматич. азосоединений они перекрываются полосами поглощения колец.
-перехода в видимую область спектра и азосоединение становится типичным красителем; введение электроноак-цепторного заместителя в сопряженное с азогруппой положение второго ароматич. остатка еще более усиливает это смещение. Соответствующим подбором заместителей в разных ароматич. остатках азосоединений можно добиться значит. углубления цвета азосоединений (см. Цветность органических соединений). Этот прием используется в синтезе азокрасителей. В ИК-спектрах характеристич. полосы поглощения vN=N у цис-изомеров и несимметричных азосоединений лежат в области 1400-1600 см -1; у ароматич. азосоединений они перекрываются полосами поглощения колец.
Алифатич. азосоединения при нагр. распадаются с выделением N2 и образованием своб. радикалов, благодаря чему, напр., 2,2'-азо-бис-изобутиронитрил, гладко разлагающийся при 60-100°С или облучении УФ-светом, применяется как инициатор свободнорадикальных р-ций. Простейший представитель алифатич. азосоединений - азометан - при осторожном нагревании устойчив до 400 °С, но при быстром нагревании разлагается со взрывом. Получают алифатич. азосоединения гл. обр. дегидрированием диалкилгидразинов действием окислителей типа К2Сr2О7 или HgO, напр.: CH3NH—NHCH3 + + [О] -> CH3N=NCH3 + Н2О.
Азосоединения, содержащие алифатич. и ароматич. остатки, более устойчивы вследствие сопряжения азогруппы с ароматич. ядром, напр. бензолазоэтан C6H5N=NC2H5-жидкость, кипящая при 180°С со слабым разложением. Получают их аналогично алифатич. азосоединениям из N-арил-N'-алкилгидразинов, напр.: C6H5NH—NHCH3 + [О] -> C6H5N=NCH3 + + Н2О.
Ароматич. азосоединения, а также гетероароматич. и смешанные, в к-рых азогруппа сопряжена с обоими остатками, как в IV и V (таутомерные енольные формы соединений I и II соотв.), устойчивы. 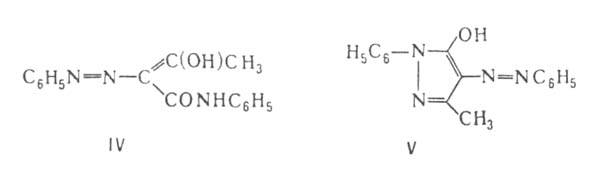
Простейший представитель ароматам. азосоединений - азобензол С6Н5М:=:МС6Н5 - мол. м. 182,22; оранжево-красные кристаллы; т. пл. 68°С, т. кип. 293°С; не раств. в воде, раств. в этаноле, эфире, бензоле, хлороформе.
При наличии в молекуле азосоединения сопряженного с азогруппой заместителя, содержащего подвижный атом Н (напр., ОН, NH2), возможна таутомерия азоидной и хинонгидразонной форм (азо-гидразонная таутомерия), напр.: 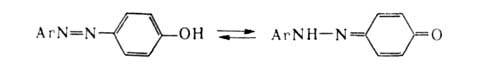
Положение равновесия зависит от хим. строения азосоединения; так, объемистые заместители в орто- и пара-положениях к азогруппе затрудняют переход в хинонгидразонную форму, поскольку нарушают планарность молекулы, создавая пространств. затруднения. Большое значение имеют также полярность р-рителя и рН среды; напр., 1-гидроксинафта-лин-4-азобензол в пиридине и в водно-щелочной среде существует почти исключительно в азоидной форме, в нитробензоле и уксусной к-те - преим. в хинонгидразонной, а в бензоле-в виде смеси приблизительно одинаковых кол-в обеих форм.
Мягкие восстановители (Na2S, соли Fe2+ в водном NH3 и др.) в мягких условиях не восстанавливают азогруппу; это позволяет, напр., не затрагивая последнюю, восстановить нитрогруппу до NH2. Более сильные восстановители и в более жестких условиях (напр., Na2Sx ; Sn, Zn, Fe, SnCl2 или ТiС13 с соляной к-той; VSO4 с H2SO4; Na2S2O4 в щелочной среде; Н2 над катализатором) расщепляют азогруппу, напр.: 
Эта р-ция используется в произ-ве нек-рых аминов, для установления строения азосоединений и их количеств. анализа, для вытравной печати узоров на тканях, окрашенных азокрасите-лями. Р-ция в нек-рых случаях м. б. остановлена на стадии образования гидразосоединений.
При действии сильных минер. к-т азогруппа способна присоединять протон и превращаться в гидразонную группу с переносом положит. заряда на остаток, связанный с азогруппой, напр.: 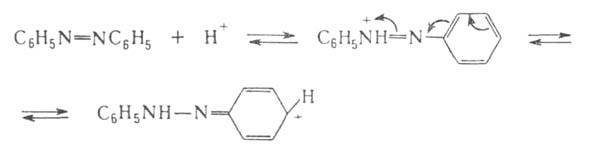
Т. к. основные св-ва азогруппы очень слабы, протонирован-ное производное уже под действием воды распадается с образованием исходного соединения.
Мягкие окислители, напр. Н2О2 в уксуснокислом р-ре, окисляют ароматич. азосоединения до азоксисоединений, сильные (дымящая HNO3 на холоду или С12)- расщепляют азосоединения по р-циям: 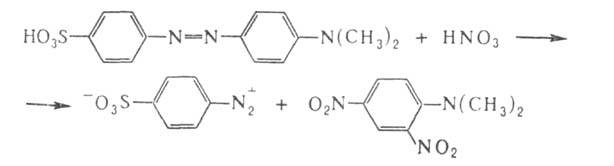
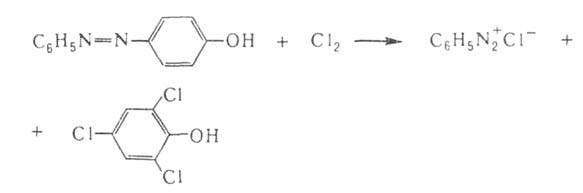
Это используется для установления строения азосоединений. Аналогично, но медленнее действует HNO2, взятая в избытке. Длительное кипячение с водой постепенно разрушает мн. ароматич. азосоединения; процесс ускоряется при нагр. с разб. к-тами и щелочами. Конц. H2SO4 при умеренных т-рах сульфирует нек-рые азосоединения, но при повыш. т-рах полностью разрушает их.
Осн. способ получения ароматич. азосоединений - азосочетание, в т.ч. окислительное. Практич. значение имеют также: взаимод. первичных аминов с нитрозосоединениями (ArNO + + Ar'NH2 -> ArN=NAr' + Н2О) или нитросоединениями с послед. восстановлением образовавшихся азоксисоединений
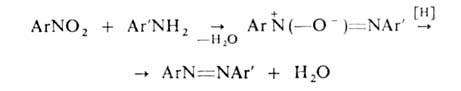
восстановление нитро-, нитрозо- и азоксисоединений, напр. ArNO2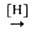 ArN=NAr + H2O; ArNO
ArN=NAr + H2O; ArNO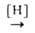 ArN=NAr + Н2О; окисление первичных аминов:
ArN=NAr + Н2О; окисление первичных аминов: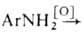 -> ArN=NAr + Н2О.
-> ArN=NAr + Н2О.
В лаб. азосоединения могут быть также получены взаимод. арилгидразинов с хинонами, окислением нек-рых диазосоед. и др. Ароматич. азосоединения широко применяют как азокрасители.
Количеств, анализ азосоединений основан на восстановит. расщеплении азогруппы при титровании р-рами VSO4, TiCl3, SnCl2 и др.; применяются также колориметрич., спектрофотометрич. и др. оптич. методы. Качеств. контроль осуществляется тонкослойной и бумажной хроматографией.
Азосоединения открыты в 1834 Э. Мичерлихом, получившим азобензол восстановлением C6H5NO2 в щелочной среде.
Литература
Вснкатарама" К., Химия синтетических красителей, пер. с англ., т. 1, Л., 1956; Химия синтетических красителей, под ред. К. Венкатарамана, пер. с англ., т. 3-6, Л., 1974-77; Цоллингер Г., Химия азокрасителей, пер. с нем., Л., 1960; Порай-Кошиц Б. А., Азокрасители, Л., 1972; Степанов Б.И., Введение в химию и технологию органических красителей, 2 изд., М., 1977; Аналитическая химия синтетических красителей, под ред. К. Венкатарамана, пер. с англ., Л., 1979. Б. И. Степанов.
