Термохимия
ТЕРМОХИМИЯ, раздел химической термодинамики, включающий определение теплового эффекта реакции и установление его зависимости от физ.-хим. параметров. В задачу термохимии входит также измерение и вычисление теплот фазовых переходов, растворения, разбавления и др. процессов, изучение теплоемкостей, энтальпий и энтропии в-в. Осн. эксперим. метод термохимии -калориметрия. Иногда используют некалоримет-рич. методы (расчет тепловых эффектов из результатов измерения констант равновесия, эдс и т.п.), однако в этих случаях результаты обычно менее точны.
Термохимия возникла в сер. 18 в. На необходимость измерения тепловых эффектов р-ций и теплоемкостей указывал еще М. В. Ломоносов; первые термохим. измерения провели Дж. Блэк, А. Лавуазье, П. Лаплас. Развитие термохимии в 19 в. тесно связано с именами Г.И. Гесса, М. Бертло, X.Томсена. Гесса закон, открытый в 1840, дает возможность определять тепловые эффекты хим. р-ций расчетным путем, в частности по теплотам образования исходных в-в и продуктов. Тем самым открывается путь для расчета таких тепловых эффектов, прямое измерение к-рых затруднительно, а иногда невозможно. Необходимые для расчета стандартные теплоты образования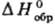 собраны в фундам. термодинамич. справочники.
собраны в фундам. термодинамич. справочники.
В сер. 19 в. Томсен и Бертло высказали идею, согласно к-рой хим. р-ции, происходящие без подвода энергии извне, протекают в направлении макс. выделения теплоты (принцип Бертло-Томсена). Ими и их учениками были разработаны осн. эксперим. методики термохимии. и измерены тепловые эффекты мн. реакций. В России в кон. 19 в. такие измерения проводил В. Ф. Лугинин, основавший термохим. лабораторию. Хотя в общем виде принцип Бертло-Томсена оказался неверен, за термохимией сохранилась ведущая роль в исследовании возможности протекания хим. р-ций в заданых условиях. Так, ур-ние
DH-TDS = -RTlnКр,
являющееся обобщением первого и второго начал термодинамики (DH-изменение энтальпии, DS-изменение энтропии при хим. р-ции, Т-т-ра, R-газовая постоянная), позволяет рассчитать константу равновесия Кр любой р-ции через тепловые величины. В настоящее время можно говорить о полном слиянии термохимии с хим. термодинамикой, т. к., с одной стороны, для характеристики в-в и хим. процессов наряду с тепловыми эффектами необходимо знать и др. термодинамич. ф-ции, а с др. стороны-расчет тепловых эффектов можно производить с помощью термодинамич. зависимостей, напр. по приведенному выше ур-нию или из температурной зависимости Кр (см. Кирхгофа уравнение).
В 20 в. совершенствование методов термохим. измерений привело к резкому повышению их точности. Один из наиб. часто применяемых эксперим. приемов-определение энтальпий сгорания в-в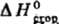 в калориметрич. бомбе в сжатом кислороде (до 3 MПa); введен в практику Бертло, модифицирован для определения энтальпий образования наиб. важных неорг. в-в (оксидов, гидридов и т.п.) и
в калориметрич. бомбе в сжатом кислороде (до 3 MПa); введен в практику Бертло, модифицирован для определения энтальпий образования наиб. важных неорг. в-в (оксидов, гидридов и т.п.) и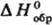 стал основным при изучении термохим. св-в орг. соединений. Значения
стал основным при изучении термохим. св-в орг. соединений. Значения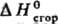 галогенорг., сераорг. и нек-рых др. в-в определяют в калориметрах с вращающимися бомбами. Точность определения
галогенорг., сераорг. и нек-рых др. в-в определяют в калориметрах с вращающимися бомбами. Точность определения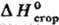 орг. в-в !0,01%. Теоретич. обработка опытных данных для орг. соед. заключается прежде всего в установлении связи между величинами
орг. в-в !0,01%. Теоретич. обработка опытных данных для орг. соед. заключается прежде всего в установлении связи между величинами 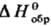 или
или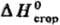 и строением молекул. Развиты методы определения
и строением молекул. Развиты методы определения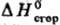 неорг. в-в во фторе (фторная калориметрия), хлоре, определение теплот гидрирования. Для осуществления таких р-ций исходные в-ва в калориметрич. бомбе часто приходится нагревать до высоких т-р (иногда до 1000-1300 °С). Др. универсальный метод термохимии -определение теплот растворения в-в в воде или теплот р-ций с водными р-рами к-т, щелочей и т.п. Эти данные позволяют включить в термохим. циклы большой круг в-в и рассчитать для них
неорг. в-в во фторе (фторная калориметрия), хлоре, определение теплот гидрирования. Для осуществления таких р-ций исходные в-ва в калориметрич. бомбе часто приходится нагревать до высоких т-р (иногда до 1000-1300 °С). Др. универсальный метод термохимии -определение теплот растворения в-в в воде или теплот р-ций с водными р-рами к-т, щелочей и т.п. Эти данные позволяют включить в термохим. циклы большой круг в-в и рассчитать для них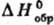 или определить теплоты неизученных р-ций. Определение теплоемкости жидкостей и р-ров, теплот растворения, смешения и испарения, а также их зависимости от т-ры и концентрации имеют самостоят. значение как эксперим. основа для разработки теории жидкого состояния (см. Жидкость). Большой интерес для практики представляют теплоты растворения электролитов в неводных и смешанных р-рителях. Для исследования тугоплавких и труднорастворимых в воде соед. во 2-й пол. 20 в. развит метод, основанный на определении теплоты растворения в расплавл. смеси оксидов (2РbО + В2О3 или 9РbO + 3CdO + 4В2O3).
или определить теплоты неизученных р-ций. Определение теплоемкости жидкостей и р-ров, теплот растворения, смешения и испарения, а также их зависимости от т-ры и концентрации имеют самостоят. значение как эксперим. основа для разработки теории жидкого состояния (см. Жидкость). Большой интерес для практики представляют теплоты растворения электролитов в неводных и смешанных р-рителях. Для исследования тугоплавких и труднорастворимых в воде соед. во 2-й пол. 20 в. развит метод, основанный на определении теплоты растворения в расплавл. смеси оксидов (2РbО + В2О3 или 9РbO + 3CdO + 4В2O3).
Современная термохимия включает произ-во прецизионной калориметрич. аппаратуры. Выпускаемые серийно в ряде стран микрокалориметры отличаются высокой чувствительностью, практически неограниченной продолжительностью измерений и широко применяются при определении небольших тепловых эффектов и теплот медленных р-ций, недоступных ранее для прямого термохим. изучения (гидролиз сложных эфиров, этерификация, гидратация оксидов, твердение цемента и др.). Развитие микрокалориметрии открыло возможности для термохим. изучения биохим. процессов и превращений макромолекул. Изучаются тепловые эффекты, сопровождающие ферментативные р-ции, фотосинтез, размножение бактерий и др. Дифференциальные сканирующие калориметры позволяют ускорить и упростить измерение теплоемкостей и теплот фазовых переходов по сравнению с классич. приборами, действующими на принципе периодич. ввода энергии.
Несмотря на совершенствование измерит. техники, термохим. эксперимент остается трудоемким, поэтому наряду с прямым определением термич. величин в термохимии широко применяют расчетные методы. Чаще всего используют эм-пирич. методы, базирующиеся на установленных термохим. закономерностях. В термохимии орг. соединений обычно DHобр вычисляют по аддитивным феноменологич. схемам, как суммы вкладов от структурных фрагментов молекулы, определяемых на основе наиб. надежных эксперим. данных.
Квантовая химия совместно со статистич. термодинамикой позволяет вычислять энергии и энтальпии образования хим. соед., однако пока, как правило, лишь для сравнительно простых систем. Методы молекулярной механики также м. б. использованы для расчета термохим. величин нек-рых классов соединении. Эти методы используют довольно большое число молекулярных параметров и, как правило, требуют корреляции с надежными термохим. данными, полученными эксперим. путем. Т. обр., эксперим. методы остаются в термохимии до сих пор основными, что способствует дальнейшему расширению исследований и совершенствованию эксперим. техники.
Главные направления эксперим. исследований в современной термохимии заключаются в надежном установлении т. наз. ключевых термохим. величин, на к-рых основаны дальнейшие расчеты, а также в изучении новых и малоизученных классов соед.-полупроводников, комплексных соед., орг. соединений бора, фтора, кремния, фосфора, серы и др. Интенсивно изучают высокотемпературные сверхпроводники, соед. РЗЭ. Возрастает применение термохимии в исследовании поверхностных явлений, др. областей коллоидной химии, радиохим. процессов, химии полимеров, своб. радикалов и т. п. Термохим. величины используют для установления связи между энергетич. характеристиками хим. соед. и его строением, устойчивостью и реакционной способностью; в качестве базовых термодинамич. данных при проектировании и усовершенствовании хим. произ-в (в частности, для расчета макс. выхода продукта и прогнозирования оптимального режима); для составления энергетич. баланса хим. реакторов в технол. процессах, исследования и прогнозирования энергоемких структур при создании новых видов топлива.
Лит.: Кальве Э., Прат А., Микрокалориметрия, пер. с франц., М., 1963; Скуратов С. М., Колесов В.П., Воробьев А.Ф., Термохимия, ч. 1-2, М., 1964 66; МищенкоК.П., Полторацкий Г.М., Вопросы термодинамики и строения водных и неводных растворов электролитов, Л., 1968; Леони-дов В.Я., Медведев В.А., Фторная калориметрия, М., 1978; Бенсон С, Термохимическая кинетика, пер. с англ., М., 1971; Experimental thermochemistry, ed. by F.D. Rossini, H.A. Skinner. v. 1-2, N. Y.-L., 1956-62; Cox J. D., Pilcher G., Thermochemistry. of organic and orgranometallic compounds, L.-N.Y., 1970; Ped1eу J. В., Nау1оr R. D., Кirbу S. P., Thermochemical data of organic compounds, 2 ed., L.-N.Y., 1986; Codata key values for thermodynamics, ed. by J.D. Cox, N.Y., 1989. В.П. Колесов.
