Фосфорной кислоты гексаметилтриамид
ФОСФОРНОЙ КИСЛОТЫ ГЕКСАМЕТИЛТРИАМИД [ГМФА, гексаметилтриамидофосфат, гексаметилфосфор-амид, оксид трис-(диметиламино)фосфина, гексаметапол, ГМТФК, гемп] [(CH3)2N]3PO, мол.м. 179,19; бесцв. подвижная жидкость со слабым аминным запахом; т. пл. 7,2 0C, т. кип. 232 0C, 94-96 °С/б мм рт. ст.; 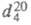 1,027;
1,027; 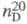 1,4569;
1,4569;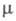 18,3 ·10-30 Кл·м;
18,3 ·10-30 Кл·м; 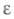 30; раств. в воде и мн. орг. р-рителях, не раств. в парафиновых углеводородах; с CHCl3 и CH2Cl2 образует неустойчивые комплексы, эти р-рители используют для экстракции ГМФА из воды.
30; раств. в воде и мн. орг. р-рителях, не раств. в парафиновых углеводородах; с CHCl3 и CH2Cl2 образует неустойчивые комплексы, эти р-рители используют для экстракции ГМФА из воды.
ГМФА - апротонный биполярный р-ригель; в нем раств. щелочные металлы, соли, многие элементоорг. соед. (напр., в среде ГМФА получают RMgX, RLi, ROM, где M - металл). Р-ры Li, Na, К в ГМФА окрашены в синий цвет, что связано с образованием ион-радикалов; в присут. других р-рителей, вероятно, образуются ионные пары:
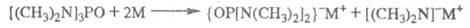
При пропускании в эти р-ры NH3 или PH3 образуются амиды MNH2 или фосфиды MPH2 металлов; последние с RHal дают первичные фосфины RPH2, наряду с к-рыми могут образоваться фосфонаты RP(O) [N(CH3)2]2 (благодаря атаке катиона R+ на анион {OP[N(CH3)2]2}-).
ГМФА обладает электронодонорными св-вами, образует устойчивые аддукты с HHal, что используют в нек-рых р-циях, напр.:
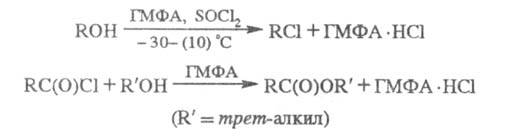
ГМФА входит в качестве лиганда в комплексы на основе переходных металлов, напр. Th {[(CH3)2N]3PO}2Cl4, U02{[(CH3)2N]3PO}4(C1O4)2 и др. При нагр. способен отщеплять HHal от органилгалогенидов (напр., HBr от a-бромкето-нов с образованием a, b-непредельных кетонов), а также фосфорилировать спирты и амины, амидировать карбоновые к-ты, напр.:
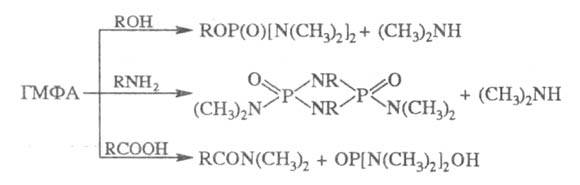
ГМФА обычно получают р-цией (CH3)2NH и POCl3 в орг. р-рителе при 60-100 0С. Р-цию проводят в избытке диметил-амина либо в присут. NH3 или др. амина. Осадок гидрохлорида амина отделяют, р-ритель отгоняют, конечный продукт при необходимости перегоняют в вакууме (выход 90-95%).
ГМФА образуется также окислением гексаметилтриамида фосфористой к-ты (окислители - N2O4, H2O2 и др.) либо р-цией диметиламина с HP(O)[N(CH3)2]2 в присут. CCl4.
Многие орг. соед. в сочетании с ГМФА используют в качестве реагентов в орг. синтезе, напр. ГМФА с перброми-дом фенилтриметиламмония [PhN(CH3)3]+Br3- - как броми-рующий агент; с тиопропилатом лития C3H7SLi - для расщепления эфиров до соответствующих к-т; с сульфурир. боргид-ридом натрия NaBH2S3 - как восстановитель кетонов, альдегидов, оксимов; смесь ГМФА с Na и трет-бутиловым спиртом - как восстановитель a, b-ненасыщ. кетонов; смесь ГМФА с KOH и трет-бутиловым спиртом - для автоокисления алкилбензолов до ароматич. карбоновых к-т, а также тиолов и дисульфидов до сульфокислот.
ГМФА - светостабилизатор ПВХ, хемостерилизатор для насекомых, промотор стереоспецифич. р-ций, р-ритель. ГМФА обладает общеядовитым действием по отношению к теплокровным, предположительно, канцерогенными св-вами. T. всп. 105 0C.
Лит.: Корбридж Д., Фосфор. Основы химии, биохимии, технологии, пер. с англ., M., 1982, с. 271; Физер Л., Физер M., Реагенты для органического синтеза, пер. с англ., т. 1, M., 1970, с. 195. Г. И. Дрозд.
