Цианэтилирование
ЦИАНЭТИЛИРОВАНИЕ (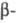 цианэтилирование), введение в молекулу
цианэтилирование), введение в молекулу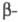 цианэтильной группы. Осуществляется действием акрилонитрила на спирты, фенолы, тиолы и др. соед. с подвижным атомом Н в присут. основных катализаторов (щелочи, алкоголяты и др.) в среде орг. р-рителя (бензол, ацетонитрил и др.). В нек-рых случаях катализаторами могут служить к-ты.
цианэтильной группы. Осуществляется действием акрилонитрила на спирты, фенолы, тиолы и др. соед. с подвижным атомом Н в присут. основных катализаторов (щелочи, алкоголяты и др.) в среде орг. р-рителя (бензол, ацетонитрил и др.). В нек-рых случаях катализаторами могут служить к-ты.
Цианэтилирование- частный случай Михаэля реакции. Цианэтилирование протекает через промежут. образование карбаниона; последний в избытке акрилонитрила способен к присоединению еще одной молекулы нитрила, напр.:
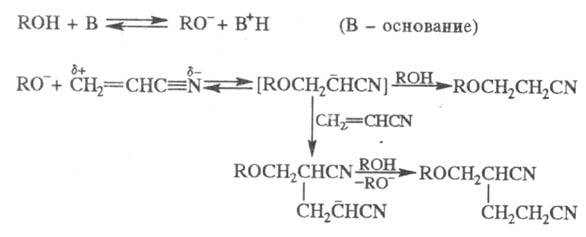
Р-ция с первичными спиртами - экзотермическая, вторичные спирты реагируют труднее первичных, третичные в обычных условиях в р-цию не вступают. Подобно одноатомным спиртам реагируют гликоли и многоатомные спирты, а также этиленциангидрин, оксимы, аминоспирты. Для последних при наличии в аминогруппе свободного атома водорода р-ция идет по атому азота.
Фенолы цианэтилируются по гидроксильной группе и в ядро, напр.:
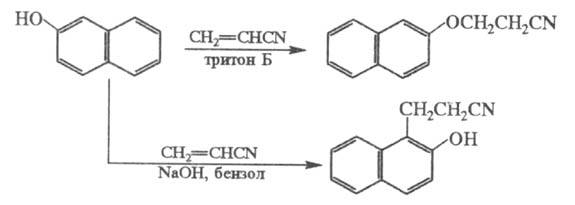
Электроотрицат. группы препятствуют р-ции; так, выход продукта цианэтилирования n-хлорфенола менее 10%.
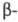 алкил(арил)тиопропионитрилам RSCH2CH2CN, цианэтилирование гидросульфитов и сульфинатов - к производным S(VI):
алкил(арил)тиопропионитрилам RSCH2CH2CN, цианэтилирование гидросульфитов и сульфинатов - к производным S(VI): 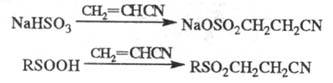
При цианэтилировании сероводорода образуется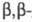 дицианодиэтилсульфид S(CH2CH2CN)2. Аналогично реагирует вода.
дицианодиэтилсульфид S(CH2CH2CN)2. Аналогично реагирует вода.
Цианэтилирование аммиака в зависимости от условий приводит к продуктам моно-, ди- и трицианэтилирования (р-ция обратимая). Первичные амины цианэтилируются в отсутствие катализатора, труднее идет р-ция с циклич. вторичными аминами (напр., пиперидином, морфолином) и еще труднее с ациклич. вторичными аминами. Ароматич. амины вступают в р-цию при повышенной т-ре в присут. кислот (H2SO4, ледяная СН3СООН и др.); ускоряют р-цию соли Сu, Zn, Co, Ni.
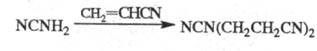
При цианэтилировании цианамида в присут. водной щелочи образуется продукт бисцианэтилирования, обладающий сильным инсектицидным действием:
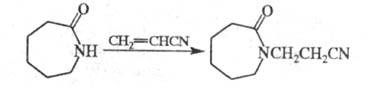
Циклич. амиды, особенно имиды, в присут. щелочей довольно легко цианэтилируются по иминогруппе:
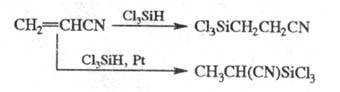
В присут. оснований силаны реагируют с акрилонитрилом по механизму цианэтилирования; в присут. Pt направление р-ции меняется:
цианэтилирования; в присут. Pt направление р-ции меняется:
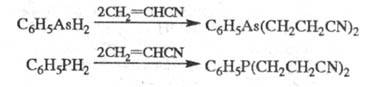
Незамещ. фосфин цианэтилируется, подобно аммиаку, цианэтилирование первичных фосфинов и арсинов приводит к бис- -цианэтилзамещенным соед.:
-цианэтилзамещенным соед.:
Гладко идет цианэтилирование галогеноводородов с образованием HalCH2CH2CN, синильной к-ты - с образованием сукцинонитрила NCCH2CH2CN.
Цианэтилирование применяют в пром-сти для получения сукцинонитрила, а также для модификации св-в нек-рых полимеров (крахмала, целлюлозы и др.).
Лит.: Терентьев А.П., Кост А.Н., в кн.: Реакции и методы исследования органических соединений, кн. 2, М- Л., 1952, с. 47-208; Kirk-Othmer encyclopedia, 3 ed., v. 7, N. Y., 1979, p. 370-85.
С. К. Смирнов, С. С. Смирнов.
