§ 11. РЕАКТИВЫ, ПРИМЕНЯЕМЫЕ В ДРОБНОМ АНАЛИЗЕ «МЕТАЛЛИЧЕСКИХ ЯДОВ» ДЛЯ МАСКИРОВКИ ИОНОВ
В дробном анализе «металлических ядов» для маскировки мешающих ионов применяются цианиды, фториды, фосфаты, тиосульфаты, тиомочевина и другие вещества.1. Цианиды. Применение цианидов для маскировки ионов основано на том, что с их помощью мешающие ионы можно перевести в комплексы:
[Co(CN) 6 ] 4-, [Fe(CN) 6 ] 4-, [Fe(CN) 6 ] 3-, [Ni(CN) 4 ] 2-, [Zn(CN) 4 ] 2-, Cd(CN) 4 ] 2-, [Hg(CN) 4 ] 2-, [Ag(CN) 2 ] -.
Образование цианидных комплексов меди происходит в 2 этапа. Вначале восстанавливаются ионы меди (II), а затем образуется комплексный ион:
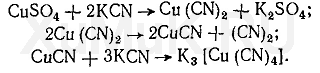
Широкое применение цианидов для маскировки ионов объясняется тем, что при необходимости из комплексных цианидов можно легко демаскировать катионы соответствующих металлов.
Следует отметить, что применение цианидов для маскировки ионов имеет и некоторое ограничение. Цианиды довольно токсичны. Их нельзя прибавлять к кислым растворам, так как в присутствии кислот происходит разложение цианидов и выделяется летучая очень ядовитая синильная кислота. Поэтому работа с цианидами должна производиться под вытяжным шкафом с хорошей тягой.
2. Фториды. Фториды часто используются для маскировки ионов железа (III), с которыми они образуют бесцветные устойчивые комплексные ионы [FeF 6 ] 3-.
3. Фосфаты. В дробном анализе фосфаты также применяются для маскировки ионов железа (III). В кислой среде фосфаты и фосфорная кислота с ионами железа образуют бесцветные комплексы [Fe(PO 4 ) 2 ] 3-.
4. Тиосульфаты. Тиосульфаты применяются для маскировки ионов серебра, свинца, железа (III), меди и других катионов. При взаимодействии тиосульфатов с перечисленными ионами образуются комплексы: [Ag 2 (S 2 O 3 ) 3 ] 4-, [Pb(S 2 O 3 ) 3 ] 4-, [Fe(S 2 O 3 ) 2 ]-.
Реакция ионов меди с тиосульфатом происходит в 2 этапа. Вначале тиосульфаты восстанавливают ионы меди (II), а затем образуются комплексы:
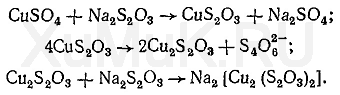
5. Гидроксиламин. Маскирующее действие гидроксиламина основано на том, что с одними ионами он образует комплексы, а с другими — вступает в реакции окисления-восстановления. С ионами кобальта гидроксиламин образует комплекс [Co(NH 2 OH) 6 ] 2+. В зависимости от природы ионов, с которыми реагирует гидроксиламин, он может быть окислителем и восстановителем. Гидроксиламин восстанавливает ионы железа (III) и окисляет ионы AsO 2 - и SbO 2 - :
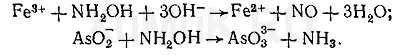
Для связывания избытка гидроксиламина применяют формальдегид, с которым он образует формальдоксим:
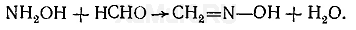
6. Тиомочевина. В дробном анализе тиомочевина используется для маскировки ионов висмута, железа (III), сурьмы (III). кадмия, ртути, серебра и других катионов. С указанными ионами тиомочевина образует прочные внутрикомплексные соединения.
7. Глицерин. С катионами висмута, свинца, кадмия и другими глицерин образует глицераты:
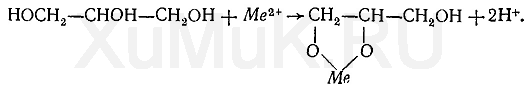
С некоторыми ионами глицерин дает окрашенные соединения. Образование этих соединений используется в анализе для идентификации ионов.
8. Комплексен III (трилон Б) широко применяется в количественном анализе. Однако этот реактив довольно часто используется и для маскировки ионов кадмия, кобальта, меди, железа, марганца, свинца, цинка, магния и др. При взаимодействии комплексона III с указанными ионами образуются прочные внутрикомплексные соединения.
Комплексон III с ионами металлов независимо от их валентности реагирует в соотношении 1 : 1. При взаимодействии ком-плексона III с ионами металлов образуются внутрикомплексные соединения за счет замещения атомов водорода в карбоксильных группах комплексона и за счет образования координационных связей между ионами металлов и атомами азота аминогрупп. Строение внутрикомплексных соединений двух- и трехвалентных металлов с комплексоном III можно представить следующими формулами;
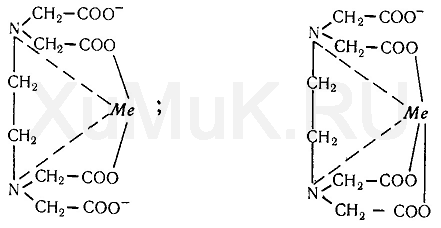
9. Лимонная кислота и ее соли (цитраты) с катионами ряда металлов дают прочные соединения, строение которых можно выразить следующими формулами:

В дробном анализе лимонная кислота используется для маскировки ионов висмута, меди, железа (III), сурьмы (III), кадмия, ртути, серебра и некоторых других.
10. Винная кислота и ее соли (тартраты) с многими металлами образуют прочные растворимые в воде комплексы:
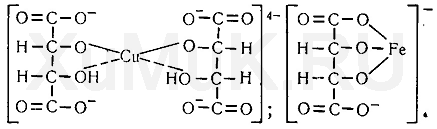
Способность винной кислоты образовывать прочные комплексные соединения с металлами используется для маскировки ионов меди, железа (III), алюминия, висмута, кадмия, ртути, свинца, цинка и др.
11. Аскорбиновая кислота. Применение аскорбиновой кислоты как маскирующего средства в основном базируется на восстановительных свойствах этой кислоты. При взаимодействии аскорбиновой кислоты с сильными окислителями она переходит в щавелевую или треоновую кислоту, а при взаимодействии с окислителями средней силы аскорбиновая кислота превращается в дегидроаскорбиновую кислоту:
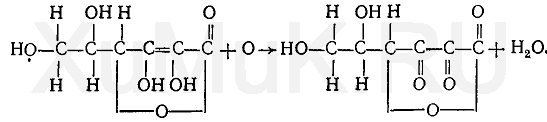
Восстанавливающие свойства аскорбиновой кислоты используются в анализе для маскировки ионов железа (III), олова (IV) и др.