Оксипиридины
ОКСИПИРИДИНЫ (гидроксипиридины, пиридинолы), производные пиридина общей ф-лы C5H4_nN(OH)n. Наиб. значение имеют моногидроксипиридины (см. ф-лу); бесцв. кристаллы; легко раств. в этаноле, ацетоне, умеренно - в воде, ограниченно-в диэтиловом эфире, бензоле, лигроине. В зависимости от положения группы ОН различают 2-, 3- и 4-оксипиридины (соотв.  -,
-,  - и
- и  -изомеры; мол.м. 95,1). Для 2-оксипиридина т.пл. 106-107 °С, т. кип. 280-281 °С; для 3-оксипиридина т.пл. 129-130°С; для 4-оксипиридина т.пл. 150-151 °С, т.кип. ок. 350 °С. Оксипиридины-слабые основания (рКа для 2-, 3- и 4-оксипиридинов соотв. 0,8, 5,2 и 3,3) и слабые к-ты (для 3-оксипиридина рКа 8,72, для 4-оксипиридина ~ 11). Образуют соли с к-тами и щелочами (т. наз. пиридоляты). Все три моногидроксипиридина способны к прототропной таутомерии. Так, в водном р-ре 2- и 4-оксипиридины находятся преим. в кетоформах, наз. пиридонами; их соли имеют гидроксипи-ридиновую структуру.
-изомеры; мол.м. 95,1). Для 2-оксипиридина т.пл. 106-107 °С, т. кип. 280-281 °С; для 3-оксипиридина т.пл. 129-130°С; для 4-оксипиридина т.пл. 150-151 °С, т.кип. ок. 350 °С. Оксипиридины-слабые основания (рКа для 2-, 3- и 4-оксипиридинов соотв. 0,8, 5,2 и 3,3) и слабые к-ты (для 3-оксипиридина рКа 8,72, для 4-оксипиридина ~ 11). Образуют соли с к-тами и щелочами (т. наз. пиридоляты). Все три моногидроксипиридина способны к прототропной таутомерии. Так, в водном р-ре 2- и 4-оксипиридины находятся преим. в кетоформах, наз. пиридонами; их соли имеют гидроксипи-ридиновую структуру.


Для 3-оксипиридина в водном р-ре характерно наличие нейтральной (Н) и биполярной (Б) форм в соотношении 1:1. В зависимости от рН среды он может также существовать в анионной (А) и катионной (К) формах:

Все моногидроксипиридины с водными р-рами FeCl3 дают типичное для фенолов пурпурное окрашивание (у 2- и 4-оксипиридинов цвет менее интенсивен, чем у 3-оксипиридина). 2-Оксипиридин обладает флуоресценцией во всех формах, 3-оксипиридин -в формах К, Б и А.
Алкилирование 3-оксипиридина может протекать по атому N или по атому О. Так, под действием СН3I или (CH3)2SO4 3-оксипиридин образует N-метил-3-гидроксипиридиниевые соли, под действием диазометана в р-ре трет-бутанола-3-метоксипири-дин. При ацилировании 3-оксипиридин образует только О-ацилпроиз-водные. 3-Оксипиридин проявляет св-ва, характерные для фенолов (реагирует с СН2О, вступает в р-цию Манниха, сочетается с солями диазония с образованием азокрасителей), напр.:

З-Оксипиридин бромируется и нитруется легко, сульфируется в жестких условиях. Наиб. реакционноспособно положение 2, наименее-4. В отличие от фенола 3-оксипиридин не вступает в р-ции ацилирования и алкилирования по Фриделю-Крафтсу.
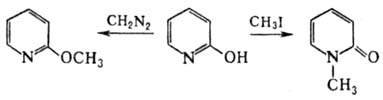
2- И 4-оксипиридины при алкилировании алкилгалогенидами или этиленоксидом превращ. в N-алкилипиридоны, при действии диазометана соотв. в 2-метоксипиридин и смесь 4-мет-оксипиридина с N-метил-4-пиридоном, напр.:
Электроф. замещение 2- и 4-оксипиридинов протекает по положениям 3 и 5. 2-Оксипиридин аминометилируется с образованием N-замещенных оснований Манниха; 4-оксипиридин в эту р-цию не вступает. Гидрокси-метилирование 2-оксипиридинов, не замещенных по атому N, происходит по атому N, замещенных-в ядро.
2-Оксипиридин обычно получают диазотированием 2-аминопириди-на или гидроксилированием пиридина (пропусканием паров пиридина над КОН при 300-320 °С), 3-оксипиридин - сплавлением пиридин-3-сульфокислоты с КОН (170°С, 1-2 ч) или из 3-ами-нопиридина. Производные З-оксипиридиныа м. б. получены перегруппировкой 2-ацилфуранов при нагр. с водным или спиртовым р-ром аммиака:

4-Оксипиридин получают обычно гидролизом 4-пиридиниопириди-нийдихлорида:

Известны все шесть изомерных дигидроксипириди-нов с мол. м. 111,10. Для 2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5-дигидроксипиридинов т.пл. соотв. 252-255, 271,5-272,5, 248, 203,5-204, 240-241, 252-253 °С (с разл.). Все дигидрок-сипиридины - кристаллич. в-ва; трудно раств. в воде и орг. р-рителях (кроме этанола); окисляются при длит. стоянии на воздухе (наименее устойчив 2,5-дигидроксипиридин); дают с р-ром FeCl3, а также с р-ром фосфорномолибденовой и фосфорновольфрамовой к-т (реактив Фолина-Дениса) цветные р-ции. В водном р-ре находятся в пиридонной форме.
Дигидроксипиридины легко вступают в р-ции электроф. замещения (нитрование, галогенирование, азосочетание, аминометилирование), в т. ч. подвергаются нитрозирова-нию, к-рое не наблюдается для 2- и 3-оксипиридинов, напр.:

Основные ориентанты замещения в 2,3- и 3,4-изомерах - -гидроксигруппы.
-гидроксигруппы.
Дигидроксипиридины м. б. получены гидроксилированием моногидроксипиридинов, а также из их амино-, галогено- и алкоксипроизводных.
Известны также все изомерные тригидроксипириди-ны с мол. м. 127,10 (напр., 2,4,6-тригидроксипиридин с т. пл. ок. 230 °С).
Многие производные оксипиридинов находят применение в медицине: бромид пиридогистамина [3-(диметилкарбамоилокси)-1-метилпиридинийбромид] - антихолинэстеразное ср-во; 3-оксипиридин -структурный фрагмент витамина группы В6; эмоксипин (гидрохлорид 2-этил-6-метил-3-гидроксипиридина) - водорастворимый антиоксидант-мембранопротектор - применяется в офтальмологии, неврологии и психиатрии; 5-иод- и N-ацетил-5-иод-2-пиридоны - рентгеноконтрастные препараты. К производным 2-оксипиридина относится алкалоид рицин; к N-аминокислотным производным 3,4-дигидроксипириди-на-алкалоид мимозин.
Лит.: Дюмаев К. М., Смирнов Л. Д., "Успехи химии", 1975, т. 44, в. 10, с. 1788-1804; Смирнов Л. Д., Дюмаев К.М., "Химия гетероциклических соединений", 1976, № 9, с. 1155-1170; их же, "Химико-фармацевтический журнал", 1982, № 4, с. 28-44; Klinsberg E., Pyridine and its derivatives, pt 3, N.Y., 1962, p. 509-891; Abramovitch R. А., в кн.: Chemistry of heterocyclic compounds, v. 14, suppl., pt 4, N. Y., 1975; Tieckelmann H., там же. v. 14, suppl, pt 3, p. 597-1180. Л.Д.Смирнов.
