Хлоранилины
ХЛОРАНИЛИНЫ (аминохлорбензолы), соед. общей ф-лы NH2C6H5-nCln. Наиб. практич. значение имеют 2-, 3- и 4-хлоранилины (ф-ла I), 2,3-, 2,4-, 2,5-, 3,4-, 3,5-дихлоранилины и 2,4,5-трихлоранилин.
Хлоранилины- бесцв., окрашивающиеся на воздухе кристаллы или жидкости (табл.); легко раств. в большинстве орг. р-рителей, к-тах, не раств. в воде (за исключением 4-хлоранилина). Слабые основания; с минер. к-тами образуют соли.
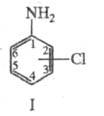
Хлоранилины обладают св-вами ароматических соединений. С 1,3,5-тринитробензолом и орг. к-тами хлоранилины образуют окрашенные комплексы, напр. комплекс 2,4,5-тринитрохлоранилина с пикриновой к-той, т. пл. 82,5 °С. Легко вступает в р-ции электроф. замещения; так, нитрование 4-хлоранилина при -20 °С приводит к смеси 2- и З-нитро-4-хлоранилинов, нитрование 2,5-дихлоранилина - к соответствующему 4-нитроанилину, хлорирование 3,4-дихлоранилина в СНС13 - к 2,3,4,6-тетрахлоранилину. Хлоранилины легко алкилируется диметилсульфатом при нагр. и ацетилируется (СН3СО)2О в бензоле с образованием соответствующих N-производных; дихлоранилины ацетилируются значительно труднее. 2-, 3- и 4-хлоранилины легко диазотируются разб. HNO2 в разб. НС1 при 0°С с образованием солей диазония, применяющихся в произ-ве азокрасителей. С альдегидами и кетонами хлоранилины дают Шиффовы основания, напр. нагревание 2-хлоранилина с бензальдегидом приводит к N-бензилиден-2-хлоранилину. 4-Хлоранилин в присут. м-нитробензолсульфокислоты взаимод. с глицерином по Скраупа реакции с образованием 6-хлорхинолина, легко фосгенируется в присут. безводного НС1 в диоксане при 70-75 °С до 4-хлорфенилизоцианата, к-рый при 25 °С с диметиланилином дает гербицид моноурон.
СВОЙСТВА ХЛОРАНИЛИНОВ
 | Мол. м. | Т. пл., °С | Т. кип., °С | 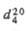 | 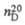 | рКа | 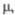 Кл х м (20 °С, бензол) Кл х м (20 °С, бензол) |
| 2а | 127,6 | -12б, -2в | 209-210 | 1,2125 | 1,5921 | 2,64 | 5,90 х 10-30 |
| 3 | 127,6 | -10,4 | 230-231 | 1,2157 | 1,5942 | 3,50 | 8,04 х 10-30 |
| 4 | 127,6 | 70,45 | 231-232 | 1,175 (70 °С) | — | 3,97 | 9,91 х 10-30 |
| 2,3 | 162,0 | 24 | 252 | 1,383 (25 оС) | — | — | — |
| 2,4 | 162,0 | 63 | 245 | 1,567 | 2,4 | — | |
| 2,5г | 162,0 | 50 | 251 | — | — | — | 5,60 х 10-30 |
| 3,4 | 162,0 | 72 | 272 | — | — | — | — |
| 3,5 | 162,0 | 51-53 | 260 | — | _ | _ | _ |
| 2,4,5 | 195,6 | 96,5 | 270 | — | — | — | — |
аТ. пл. гидрохлорида 235 оС (в запаянном капилляре). бДля а-формы. вДля в-формы. г Т. пл. гидрохлорида 165 оС, сульфата 196-197 °С.
В пром-сти хлоранилины получают гидрированием соответствующих хлорнитробензолов (Pt-кат., 50-100 °С, 0,25-3 МПа); во избежание дегалогенирования применяют добавки (0,1-1% по массе) MgO, CaO, пиперидина или морфолина.
Хлоранилины - азогены при произ-ве азокрасителей, пигментов, капрозолей, сырье для получения лек. ср-в, гербицидов и инсектицидов.
Для 2-, 3- и 4-хлоранилинов т. всп. соотв. 127,2, 124 и 123 °С, т. воспл. 707, 688 и 650 °С. Хлоранилины поражают центр. нервную систему, печень и почки; всасываются через кожу. ЛД50 256 (2-хлоранилин), 334 (3-хлоранилин), 228 (4-хлоранилин) мг/кг (мыши, перорально). ПДК в воздухе рабочей зоны 0,05-0,3 мг/м3; ПДК 2,5- и 3,4-дихлоранилинов в воде водоемов хозяйств.-бытового пользования 0,05 мг/л.
Лит.: Венкатараман К., Химия синтетических красителей, пер. с авт., т. 1, Л., 1956, с. 105; Общая органическая химия, пер. с англ., т. 3, М., 1982, с/188-90; Ullmann's Encyklopаdie, 4 Aufl., Bd 7, Weinheim, 1974, S. 570; Kirk-Othmer encyclopedia, 3 ed., v. 2, N.Y., 1978, p. 318; там же, v. 7. N.Y., 1979, p. 820; там же, v. 12, N.Y., 1980, p. 300, 319, 327.
С. И. Диденко.
