Синильная кислота (цианистый водород) и ее соли
Соли синильной кислоты образуются при накаливании угля или органических веществ в атмосфере азота в присутствии щелочных металлов или сильных оснований, а также при нагревании с теми же металлами и основаниями азотистых органических веществ. При пропускании аммиака через раскаленный уголь образуется цианистый аммоний.
Цианистые соли находят значительное практическое применение: для извлечения золота из руд, в гальванопластике, для изготовления берлинской лазури и пр. Из комплексных цианистых солей наибольшее значение имеют K4Fe(CN)6 ∙ 3H2O (ферроцианид калия, железистосинеродистый калий, желтая кровяная соль) и K3Fe(CN)6 (феррицианид калия, железоснеродистый калий, красная кровяная соль).
Старейшим промышленным способом получения цианистых солей является прокаливание животных остатков (крови, обрезков рога, кожи и пр.) с поташом и железными опилками. При этом получается ферроцианид.
Позднее стали применяться и другие способы получения цианидов:
1. Пиролиз три метиламин а, образующегося при сухой перегонке свекловичной патоки, или меляссы (из находящегося в ней бетаина), причем получаются синильная кислота и метан:
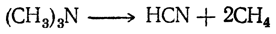
2. Нагревание древесного угля с натрием в струе аммиака. При этом сначала при 500—600°С получается амид натрия
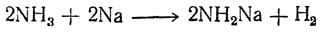
образующий с углем цианамид натрия
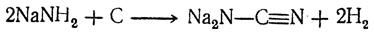
при 800° С превращающийся в цианистый натрий:
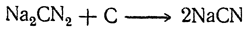
Аналогичным образом может быть превращен в цианистые соли и цианамид кальция.
Цианистый калий может быть получен нагреванием ферроцианида
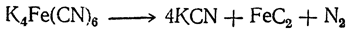
или действием на него поташа (при этом получается смесь цианида и цианата калия):
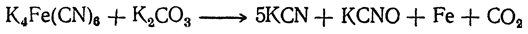
Одним из наиболее простых способов получения цианидов щелочных металлов является нагревание ферроцианида с натрием:
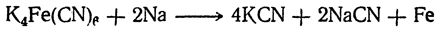
Цианистые соли могут быть легко получены из азотистого магния (нитрида магния) при накаливании его с содой и углем:
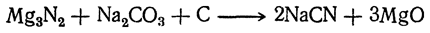
Можно и непосредственно действовать азотом на смесь магния, соды и угля при повышенной температуре.
Большие количества цианистых солей накапливаются в твердых сорбентах при очистке коксового газа.
Из солей синильной кислоты лишь соли щелочных и щелочноземельных металлов и цианистая ртуть (соль окиси ртути) растворимы в воде. Цианистые соли обладают большой склонностью образовывать двойные и комплексные соли.
Синильная кислота получается нагреванием цианистого калия или натрия, а также желтой кровяной соли с разбавленной серной кислотой. Из водного раствора путем дробной перегонки может быть выделена безводная синильная кислота.
Синильная кислота может быть получена непосредственно из элементов при пропускании азота и водорода через раскаленный уголь. Эта реакция обратима. При атмосферном давлении и 2148° С получается 4,7% HCN.
Синильная кислота может получаться в промышленном масштабе по методу Андрусова — окислением воздухом аммиака и метана на платиновом катализаторе:
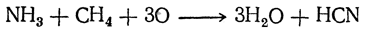
Синильная кислота в довольно значительных количествах встречается в растениях как в свободном, так и в связанном виде, особенно в виде гликозидов, например амигдалина.
Богаты гликозидом синильной кислоты некоторые разновидности бобов (Phaseolus linatus). В листьях яванского растения Pangium edule находится значительное количество свободной синильной кислоты.
Безводная синильная кислота — бесцветная жидкость, сильно пахнущая горьким миндалем, растворимая в воде; относительная плотность 0,697 (при 18°С), т. кип. +25° С. Синильная кислота — один из сильнейших ядов. Чрезвычайно ядовиты также и ее соли, причем наиболее ядовитыми являются соли, электролитически диссоциирующие в водных растворах.
Очень разбавленные растворы синильной кислоты применяются в медицине как успокоительное средство. Для этой цели используют отгон гидролизованных действием кислот листьев лавровишни, косточек абрикоса и пр., выпускаемый под названием горькоминдальной воды или лавровишневых капель. Под этим же названием применяют также и растворы чистой синильной кислоты.
Синильная кислота — одна из самых слабых кислот; ее константа электролитической диссоциации (K20=4,8 ∙ 10–4) приблизительно в 10 000 раз меньше, чем уксусной кислоты. Ее можно рассматривать как нитрил муравьиной кислоты. Действительно, синильная кислота получается перегонкой с фосфорным ангидридом формиата аммония, а присоединяя воду, образует муравьиную кислоту и аммиак.
Чистая безводная синильная кислота довольно устойчива, но в присутствии следов влаги, аммиака, цианистых солей и других примесей, а также в водных растворах быстро разлагается, особенно на свету, причем образуются аммиак, муравьиная и щавелевая кислоты и бурые нерастворимые азульминовые вещества.
Синильная кислота обладает сильной склонностью к реакциям присоединения (присоединяет хлористый водород, сероводород, сернистую кислоту и т. д.). При восстановлении дает метиламин:
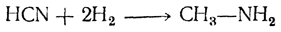
Синильная кислота способна полимеризоваться.
Для тримолекулярной синильной кислоты, образующейся вместе с рядом других продуктов при стоянии слабощелочных растворов, доказано строение нитрила аминомалоновой кислоты NC—CH(NH2)—CN.


